

干細胞的出現極大地推動了再生醫學的發展,涵蓋了基于細胞的高通量藥物篩選、細胞移植和器官移植等應用領域,展現了廣闊的應用前景。干細胞行業,尤其是間充質干細胞治療的快速發展,方興未艾。
隨著對間充質干細胞治療機理的深入研究,研究發現間充質干細胞通過外泌體來發揮治療作用,從而推動了干細胞外泌體的研究和發展。
2013年,諾貝爾生理學或醫學獎授予了三位科學家,表彰其在細胞間囊泡運輸調控機制領域作出的突出貢獻。諾獎的肯定,使得胞外囊泡及其生理學功能成為熱點,得到廣泛研究。
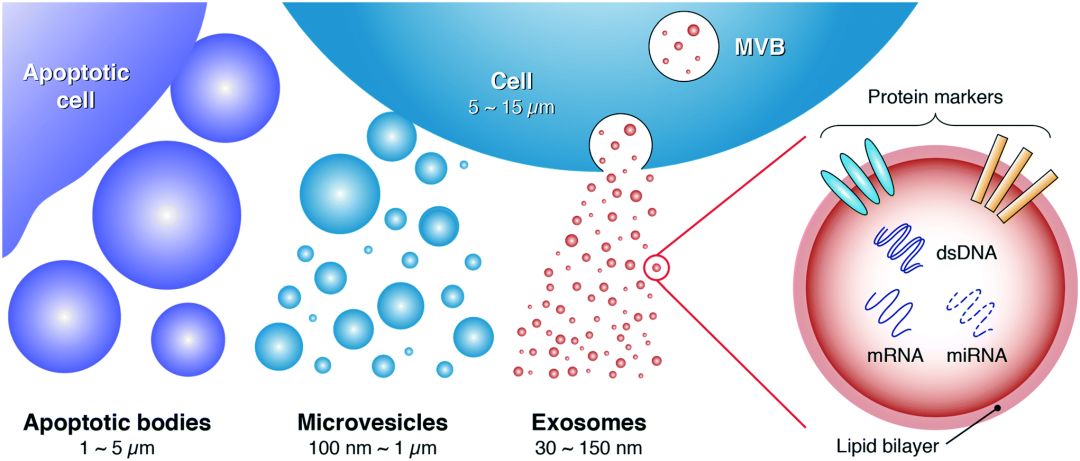
不同類型的細胞均可通過出芽方式釋放各種各樣的囊泡(如外泌體、微囊泡、凋亡小體)到細胞外,囊泡大小從40nm到毫米不等,統稱為胞外囊泡(Extracellular Vesicles,EV)。
EV的外層為磷脂膜,內層由特定類型的蛋白質組成,包括酶、生長因子、受體、細胞因子、脂質、RNA和代謝物。直徑30~150nm的胞外囊泡,即為外泌體(exosome)。
早在20世紀60年代,EV的生理特性得到闡述,EV可在細胞、器官之間,甚至有機體之間傳遞信息,在血液、尿液、腦脊液、母乳和唾液等體液中均能檢測到。具有運輸和轉移生物活性分子,介導靶向細胞間信號傳遞、遺傳信息的功能性轉移等作用。
間充質干細胞(MSC)分泌大量的EV,EV內容物包括蛋白和RNA(>80%),以及一些小RNA,其中miRNAs約44%、tRNA約47%。MSC通過EV與其他細胞實現信息交流,發揮治療作用。MSC-EV可表達MSC表型標記,如CD29、CD73、CD44和CD105。
已在MSC-EV中發現850多個獨特的基因產物和160多個miRNAs。
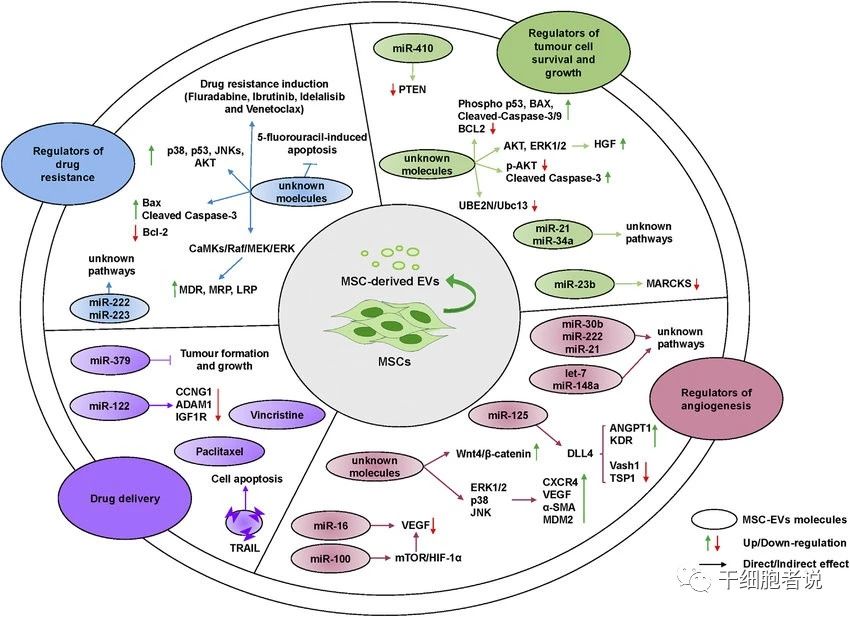
MSC-EV已在幾種不同類型的疾病中顯示出令人鼓舞的治療效果,包括腎損傷、心臟損傷、腦損傷和肝肺損傷等。主要機制可能是MSC-EV介導了MSC的旁分泌/自分泌機制。
急慢性腎損傷方面,MSC-EV中的生長因子mRNA可轉移到順鉑損傷的近端腎小管上皮細胞(PTEC),促進PTEC增殖;IGF-1R的mRNA通過體外水平轉移到腎小管上皮細胞,增強了腎小管細胞對局部產生的IGF-1的敏感性。如果骨髓MSC-EV的miRNA耗竭,則在急性腎損傷中MSC-EV的再生修復能力顯著降低,提示在急性腎損傷恢復中,miRNAs起著關鍵作用。
心肌梗死方面,體外擴增的MSC培養上清液已成功用于縮小小鼠心肌梗死范圍。MSC上清液的促再生活性被證明為EV組分,去除EV后則沒有作用效果。MSC-EV介導的細胞保護作用可減輕大腸桿菌內毒素誘導的小鼠急性肺損傷和低氧誘導的肺動脈高壓。MSC-EV還展示了減輕藥物誘導肝損傷和肝纖維化的能力。
MSC-EV可直接促進血管生成。在大鼠模型中,MSCEV可顯著改善后肢缺血灌注,加速皮膚燒傷后的再上皮化,并提高同種異體皮膚移植物的存活率。在中風模型缺血性閉塞后,MSC-EV給藥可促進功能恢復和新生血管,顯著改善卒中誘導后的功能,但是MSC組和MSC-EV組沒有明顯的療效差異。
在綿羊模型中,應用MSC-EV可觀察到大腦缺氧損傷的改善。miRNA-133b似乎與MSC-EV介導的大鼠缺血性卒中后的功能恢復有關,而miRNA-22似乎與MSC-EV介導的缺血性心臟病心肌細胞的抗凋亡作用有關。
因此,MSC-EV可用于中風的治療,作為干細胞輸注的替代方法,改善神經預后,增加血管與神經生成。
MSC-EV對多種類型的免疫細胞均具有免疫調節作用,包括樹突狀細胞、T細胞、B細胞和巨噬細胞。在關節炎模型中,MSC-EV體內炎癥抑制作用比MSC更強。
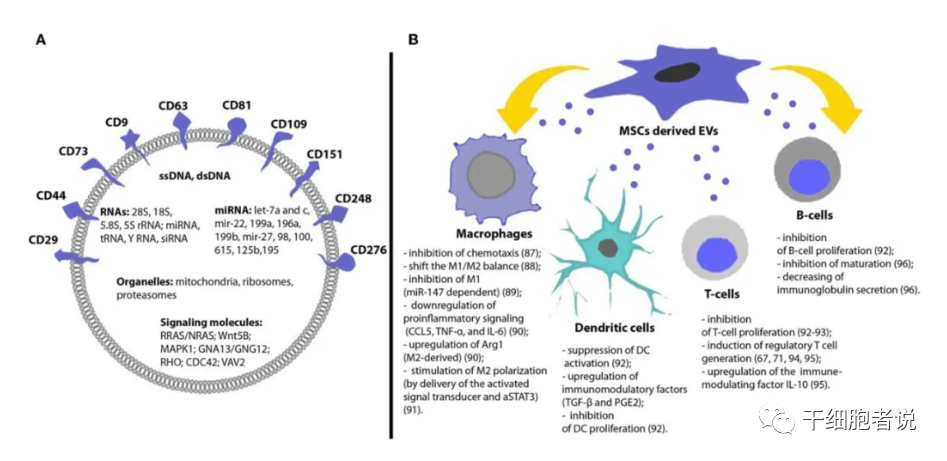
MSC-EV的免疫調節作用包括:1)通過miRNAs介導DC的免疫調節;2)通過增強M2巨噬細胞極化和間接驅動T細胞誘導發揮免疫抑制作用;3)抑制健康供者和GvHD患者NK細胞和其他外周白細胞的激活;4)在體外與PBMC共培養時抑制T細胞的激活,促進調節性CD4+、CD25+、FOXp3+、T細胞的增殖;5)高度表達GVHD改善相關的多種可溶性因子,靜脈輸注MSC-EV可抑制CD4+T和CD8+T細胞的活化和浸潤,從而延長GVHD小鼠模型的存活時間,并減少多個器官的病理損傷。
在小鼠體內的生物發光和熒光介導的斷層成像顯示,EV靜脈注射主要分布在脾、肝、肺和腎,30分鐘內在腦、心臟和肌肉中可檢測到EV,60分鐘后尿液中可檢測到EV。
已經觀察到,MSC-EV的促腫瘤和抗腫瘤作用,目前尚無給藥的任何副作用報道,可以認為MSC-EV給藥基本上安全,且由于EV不能自我復制,無內源性腫瘤形成潛力。
2011年,進行了第一次有記錄的臨床MSC-EV給藥,MSC-EV以遞增的劑量應用于1例類固醇耐藥的GVHD患者,4×107個MSC培養上清液分離的MSC-EV(1.3-3.5×10*10個顆粒或0.5~1.6mg)被定義為1個單位,每隔2~3天靜脈注射一次,共2周,總共接受4個單位,GVHD癥狀顯著下降,每日類固醇劑量可從125mg減少到30mg,治療后穩定了5個月,MSC-EV給藥耐受性良好,未觀察到副作用。
對20例慢性腎臟病患者進行的Ⅱ/Ⅲ期臨床研究表明,臍帶MSC-EV(輸注2次,相隔1周)可改善腎小球濾過率、血肌酐水平、血尿素和尿白蛋白肌酐比值,伴隨著TGF-β1、IL-10水平明顯升高和血漿TNF-α水平顯著下降,沒任何副作用。
MSC-EV用于8例患者牙槽骨再生研究發現,無不良反應,放射學評估顯示所有病例均有早期骨形成,注射部位的炎性淋巴細胞浸潤很少,研究證明MSC-EV在骨再生方面具有較大的潛力。
對7例長期存在大型特發性難治性黃斑裂孔患者,年齡51~75歲,行玻璃體切除、內界膜剝離、MSC(2例)或MSC-EV(5例)玻璃體腔內注射;5例MH閉合術患者最佳矯正視力提高,其中1例接受MSC治療的患者在視網膜表面觀察到纖維膜,1例接受較大劑量MSC-EV的患者出現炎癥反應。
MSC-EV具有免疫調節活性并促進再生過程,其方式顯然與MSC相當。因此,基于EV的無細胞療法,為多種疾病提供了一種基于干細胞治療的有前途的替代方案。與細胞療法相比,EV療法具有一些優勢,但由于該領域的新穎性,其臨床分級生產、質量保證和應用缺乏國際公認的指南。
改變MSC的培養環境,用不同的外界刺激預處理,這不僅可以影響EV的產量,還可以調節它們的成分。例如,中風患者血清培養或缺血腦組織提取液處理,都可激活MSC釋放更多的EV。MSC培養時給予炎癥刺激,將增強抗炎特性的EV釋放。
與傳統的2D培養相比,微載體3D培養中,MSC分泌更高的EV,并降低整合素的表達。3D培養在MSC-EV生產中可能優勢,包括:1)需要大量的培養基才能獲得大量臨床使用的EV;2)持續的培養基灌流,可避免代謝副產物的積累;3)控制進出生物反應器的培養基流量可連續產出。
超速離心是收集EV最常用、最常規的方法。市面上可買到一種快速、簡單的試劑盒,其分離方法相對粗糙、易引起可溶性蛋白污染。
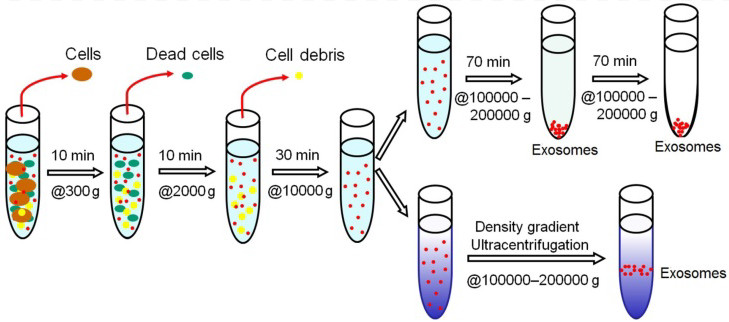
超速離心方法可獲得純EV用于科研,但在臨床上耗時長,不適合大規模生產。超速離心聚集囊泡,易于分離到可溶性因子和蛋白質。基于密度梯度的分離EV,效率最高。一些新興的技術,如尺寸排除色譜、聲學分離、納米捕捉器、流場流動分級,都有可能從不同的樣品基質中分離出EV。
EV的質量保證是后續治療的基礎。雖然有研究表明,MSC-EV發揮了治療作用,且無副作用,但必須建立適當的質量控制標準,以確保所產生的EV產品的質量、安全性和有效性得到保障。如EV應儲存在等滲緩沖液中,以防止儲存和凍融循環期間的pH變化。
干細胞外泌體的深入研究有助于闡述干細胞治療的精準機制,而且干細胞外泌體有可能在治療應用領域替代干細胞。干細胞外泌體(特指MSC-EV)是一個研究和應用都值得期待的好方向,但是需要腳踏實地地去做些工作。
因此,為了開發基于EV的藥物,至少需要在以下方面產生突破:1)適用于大規模制備、純化和儲存的分離方案;2)量化、分子和物理表征的標準化方案;3)明確的臨床使用質量控制標準。
本文來源于《醫學參考報》干細胞與再生醫學頻道2020-04期第4版文章