

說起免疫療法,很多人可能都已經(jīng)知道PD-1和CAR-T,但這只是冰山一角。
1986年的體外研究表明,從手術(shù)切除的惡性黑色素瘤中獲得的人源TILs含有能夠特異性識別自體腫瘤的T淋巴細(xì)胞,當(dāng)存在大量的腫瘤浸潤淋巴細(xì)胞時,表明機(jī)體啟動了對抗腫瘤的免疫反應(yīng)。
這些研究使得Rosenberg1988年首次證明使用自體TILs的過繼性T細(xì)胞療法可以介導(dǎo)轉(zhuǎn)移性惡性黑色素瘤患者的腫瘤客觀消退。
研究表明,浸潤腫瘤的免疫細(xì)胞數(shù)量與患者的生存機(jī)會成正比。黑色素瘤是具有相對高的突變負(fù)荷的癌癥之一,腫瘤被這些免疫細(xì)胞浸潤。
Rosenberg認(rèn)為,癌細(xì)胞入侵時,自身的免疫系統(tǒng)會試圖打敗體內(nèi)蔓延的腫瘤。
過去三十年間,他和他的團(tuán)隊一直在致力做一件事情:如何發(fā)現(xiàn)并放大“打敗”工作做得最好的那部分免疫系統(tǒng)細(xì)胞。這就是TIL--瘤浸潤的淋巴細(xì)胞。
目前,美國國家癌癥研究所NCI在這方面已經(jīng)取得了非常大的成功,并且已在其他主要癌癥中心實施治療,例如Moffitt癌癥中心。
2019年,F(xiàn)DA授予腫瘤浸潤淋巴細(xì)胞(TIL)治療方法LN-145為突破性的治療指定,這是用于實體瘤的細(xì)胞免疫療法首次獲此殊榮,相信距離上市也僅是時間問題,一旦FDA批準(zhǔn),這將是首款用于實體瘤的細(xì)胞免疫療法,將給癌癥患者帶來巨大的生存獲益。
在癌癥的早期階段,免疫系統(tǒng)試圖通過動員淋巴細(xì)胞的特殊免疫細(xì)胞來攻擊腫瘤。淋巴細(xì)胞具有識別和攻擊腫瘤流量的能力,并深入腫瘤。這些細(xì)胞被稱為腫瘤浸潤淋巴細(xì)胞(TIL),是由免疫界泰斗Rosenberg及其團(tuán)隊發(fā)現(xiàn)的。
Rosenberg博士認(rèn)為它們才是深入到敵軍內(nèi)部打擊能力最強(qiáng)的免疫細(xì)胞,但是由于一些原因(比如腫瘤微環(huán)境和PD-1),他們的功能受到了抑制,不能在腫瘤組織中有效的殺傷腫瘤細(xì)胞。但是,科學(xué)家通過一些體外培養(yǎng)方法把這些腫瘤組織中的某類型的淋巴細(xì)胞富集起來,再回輸給患者,就能夠發(fā)揮抗腫瘤作用,而且聯(lián)合PD-1效果會更好。
首先免疫細(xì)胞來源不同,TIL的免疫細(xì)胞來自于腫瘤組織,而其他細(xì)胞免疫療法大部分來取自血液,這直接決定了免疫細(xì)胞識別腫瘤的能力。據(jù)估計,腫瘤里分離出的免疫細(xì)胞,有60%以上能識別腫瘤,而血液里面分離的免疫細(xì)胞,不到0.5%。
其次,這種新型的療法不是簡單的擴(kuò)增回輸,而是要確定患者病例中特定的突變。之后利用突變信息找到能夠最有效瞄準(zhǔn)這些突變的T細(xì)胞,最后提取出專門患者腫瘤中細(xì)胞突變的T細(xì)胞,這些細(xì)胞具有精準(zhǔn)識別癌細(xì)胞的能力。
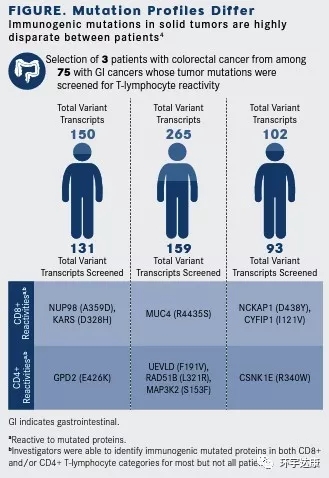
Rosenberg對常見胃腸道癌的患者的研究證明了不同患者之間免疫應(yīng)答的獨特性。通過對75位患者的生物學(xué)樣本進(jìn)行全外顯子測序,確定了124個新抗原的TIL。他們發(fā)現(xiàn),83%(62)的患者培養(yǎng)的TIL能夠試別自體腫瘤細(xì)胞表達(dá)的1.6%的體細(xì)胞突變。99%的新抗原決定簇在每個癌癥患者中都是完全不同的。因此,必須從每個癌癥患者中取出細(xì)胞,確定哪些細(xì)胞可以真正識別和攻擊癌癥,將這些細(xì)胞進(jìn)行培養(yǎng),擴(kuò)增才能起到治療效果,這是非常復(fù)雜的。
第三,這些免疫細(xì)胞經(jīng)過體外培養(yǎng)后,重新注入到患者體內(nèi)。同時,研究團(tuán)隊聯(lián)合使用了免疫增強(qiáng)藥物白細(xì)胞介素2和另一種“明星抗癌藥”PD-1抑制劑Keytruda,Keytruda即屬于另一種免疫療法免疫檢查點阻斷,在某些癌癥中有顯著的效果。
基于上述操作過程,該新療法被認(rèn)為是為患者“量身定制”。
一,晚期結(jié)直腸癌4年無進(jìn)展
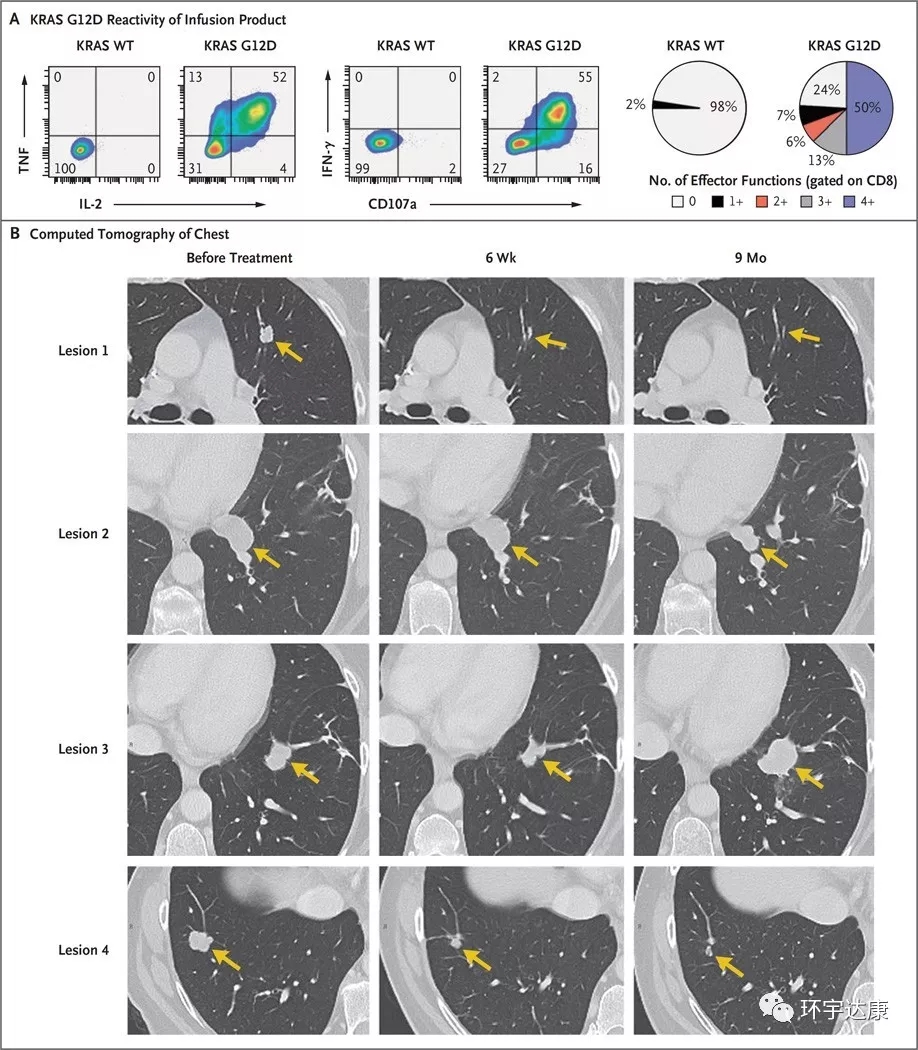
在2016年發(fā)表的文獻(xiàn)中,埃里克·特蘭(Eric Tran)與羅森伯格(Rosenberg)和其他研究人員合作,研究了使用這種方法成功治療轉(zhuǎn)移性結(jié)直腸癌患者的方法。接受靶向KRAS G12D突變的TIL治療后,患者肺部的七個轉(zhuǎn)移灶中6個病灶消失殆盡,其中三個完全消失,患者在4年后仍然沒有疾病進(jìn)展。
二,晚期宮頸癌完全緩解
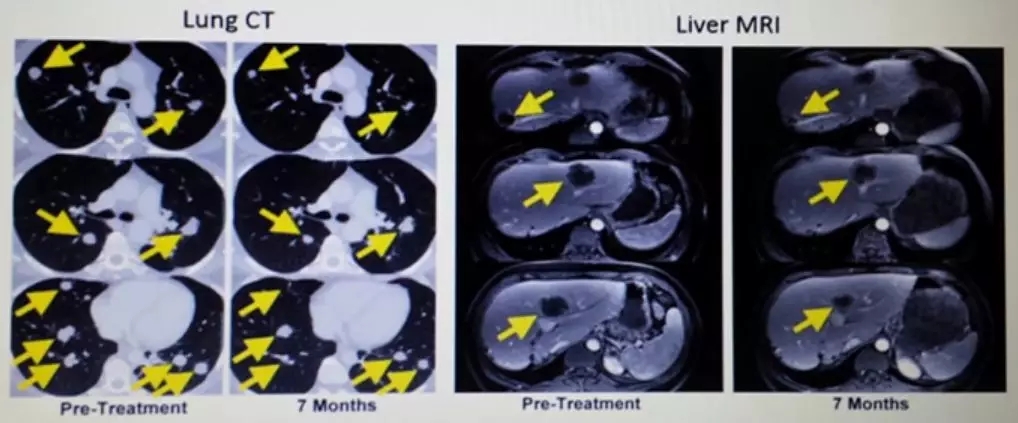
一名患有轉(zhuǎn)移性鱗狀細(xì)胞癌并接受了多種聯(lián)合化療方案,包括順鉑,長春新堿和博來霉素,然后用吉西他濱加順鉑聯(lián)合放療。隨后發(fā)現(xiàn)轉(zhuǎn)移,包括主動脈旁,雙側(cè)肺門,顱下和髂骨部位(圖1A和1C)。治療后,她在所有疾病部位都完全消退(圖1A和1C)。
另一患者患有轉(zhuǎn)移性腺癌。她的原發(fā)性腫瘤對化放療無效。隨后轉(zhuǎn)移到更多的腹膜后淋巴結(jié)和肝臟表面,在TIL治療前,她在腹膜后,腹壁,旁系,肝旁和盆腔部位有腫瘤進(jìn)展(圖1B和1d)。在治療后,出現(xiàn)完全的臨床緩解(圖1B和1d)。

三,晚期膽管癌成為十年超級幸存者!
據(jù)報道,通過使用靶向蛋白ERBB2IP突變的TIL療法,晚期膽管癌肝轉(zhuǎn)移,術(shù)后出現(xiàn)雙肺多發(fā)轉(zhuǎn)移的患者也取得了令人震驚的治療效果。
當(dāng)超過1000億個專門識別腫瘤細(xì)胞的免疫細(xì)胞,浩浩蕩蕩地進(jìn)入了這位已經(jīng)到了鬼門關(guān)患者的體內(nèi)。 效果真的驚人!她全身腫瘤開始迅速縮小,體力恢復(fù)很快。
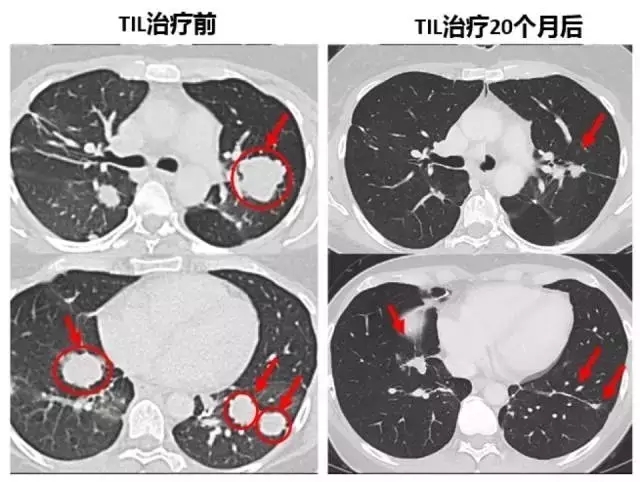
下面的對照圖可以非常明顯看到,第二次治療前肺部布滿的腫瘤,包括一些個頭非常大的,第二次TIL治療20個月后復(fù)查,這些腫瘤都非常顯著的縮小了,現(xiàn)在她已經(jīng)成為了十年幸存者!
四,晚期乳腺癌完全緩解!
2018年,《自然醫(yī)學(xué)》(Nature Medicine)上發(fā)表的一份報告描述了在用對4種突變蛋白(SLC3A2,KIAA0368,CADPS2和CTSB)的TILs治療的患者中成功治療化學(xué)難治性激素陽性轉(zhuǎn)移性乳腺癌。在報告發(fā)表時,反應(yīng)已經(jīng)持續(xù)進(jìn)行了22個月以上,并且患者在4年后仍然沒有疾病。
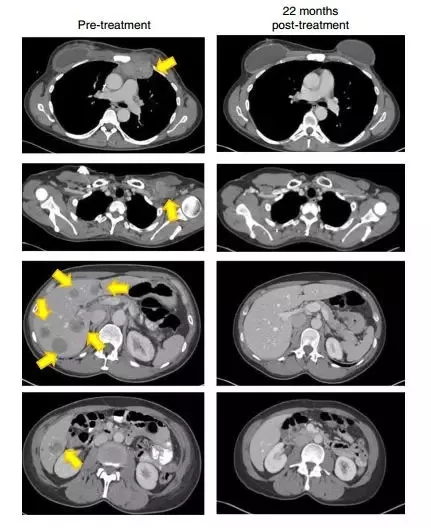 22個月后,這名患者的腫瘤(黃色箭頭)消失得無影無蹤(圖片來源:《Nature Medicine》)
22個月后,這名患者的腫瘤(黃色箭頭)消失得無影無蹤(圖片來源:《Nature Medicine》)
一、首個實體瘤細(xì)胞免疫療法獲FDA突破性療法稱號!
2019年6月,F(xiàn)DA批準(zhǔn)腫瘤浸潤淋巴細(xì)胞(TIL)治療方法LN-145為突破性的治療指定,這是用于實體瘤的細(xì)胞免疫療法首次獲此殊榮,相信距離上市也僅是時間問題,一旦FDA批準(zhǔn),這將是首款用于實體瘤的細(xì)胞免疫療法,將給癌癥患者帶來巨大的生存獲益。
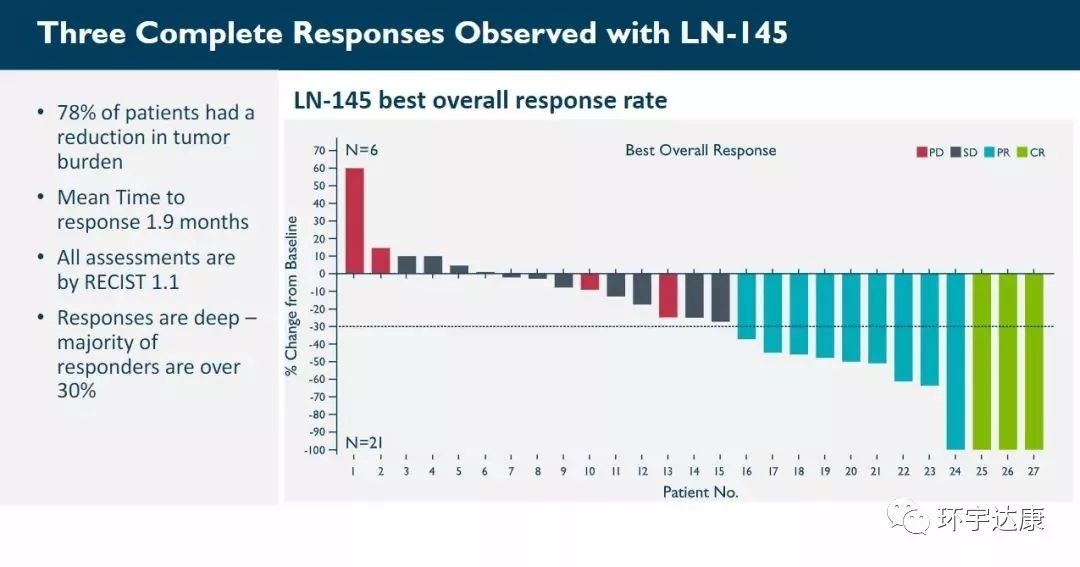
FDA此次授予是基于正在進(jìn)行的第二階段innovaTIL-04(C-145-04)積極的試驗的數(shù)據(jù),摘要數(shù)據(jù)顯示,晚期宮頸癌患者的TIL治療總體反應(yīng)率(ORR)為44%。
在2019年2月4日的數(shù)據(jù)截止時,有27名可評估的患者。
■ 44%(12名)的患者有效果,包括1名完全應(yīng)答,9名部分應(yīng)答和2個未確認(rèn)的部分應(yīng)答;
■ 疾病控制率為89%;
■ 中位隨訪時間為3.5個月,12例患者中有11例持續(xù)應(yīng)答;
■ 沒有任何嚴(yán)重的副作用發(fā)生。
疾病控制率89%!首個迎戰(zhàn)實體瘤的細(xì)胞免疫療法獲FDA突破性療法稱號!
二、疾病控制率80%,晚期黑色素瘤的新希望
LN-144是由Iovance公司近期研發(fā)的基于自體腫瘤浸潤淋巴細(xì)胞(TIL)的另一種專門針對黑色素瘤的免疫療法,這是一種基于T細(xì)胞的過繼性細(xì)胞療法(ACT)。此外過繼性細(xì)胞療法還有大家知道的用T細(xì)胞受體(TCR)或基因工程改造表達(dá)嵌合抗原受體(CAR)的自體T細(xì)胞,回輸?shù)交颊唧w內(nèi)以誘導(dǎo)自身免疫的抗腫瘤作用。
Iovance的創(chuàng)新細(xì)胞療法是基于患者自身的TIL。這些TIL在癌癥發(fā)生時會遷移到腫瘤處并且對腫瘤發(fā)起攻擊。然而,通常患者體內(nèi)的TIL數(shù)目不足以消滅腫瘤,而且腫瘤微環(huán)境會抑制TIL的功能。Iovance的T細(xì)胞癌癥免疫療法從患者體內(nèi)獲取腫瘤組織并且提取TIL,然后在體外使用IL-2細(xì)胞因子刺激TIL的擴(kuò)增。這一體外刺激手段不但增加了TIL的數(shù)量,而且激活TIL的抗腫瘤能力。然后這些TIL被注回患者體內(nèi),更有效地殺傷腫瘤細(xì)胞。
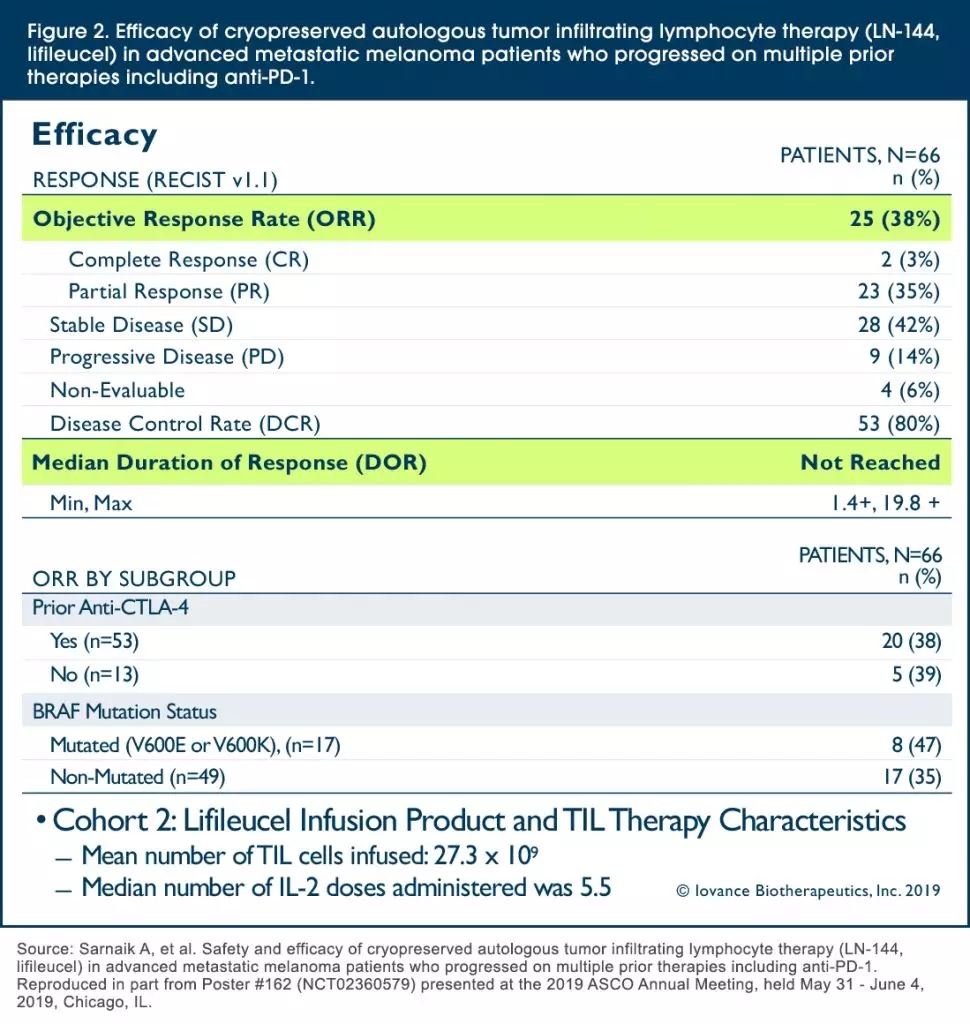
在一項最新的2期臨床試驗結(jié)果顯示,66例接受過PD-1治療晚期黑色素瘤患者的試驗中:
1、疾病控制率(DCR)高達(dá)80%;
2、客觀緩解率達(dá)到38%,包括2例(3%)完全緩解,23例部分緩解(35%)和28例(42%)病情穩(wěn)定;
3、中位隨訪時間為8.8個月,未達(dá)到中位反應(yīng)持續(xù)時間。
更引人注目的是,患有PD-L1陰性的患者也有響應(yīng),這說明對免疫檢查點抑制劑無效的患者仍能獲益于TIL療法。
對于PD-1治療后進(jìn)展的患者,幾乎沒有其他治療選擇,這種治療方案的效果幾乎無與倫比。
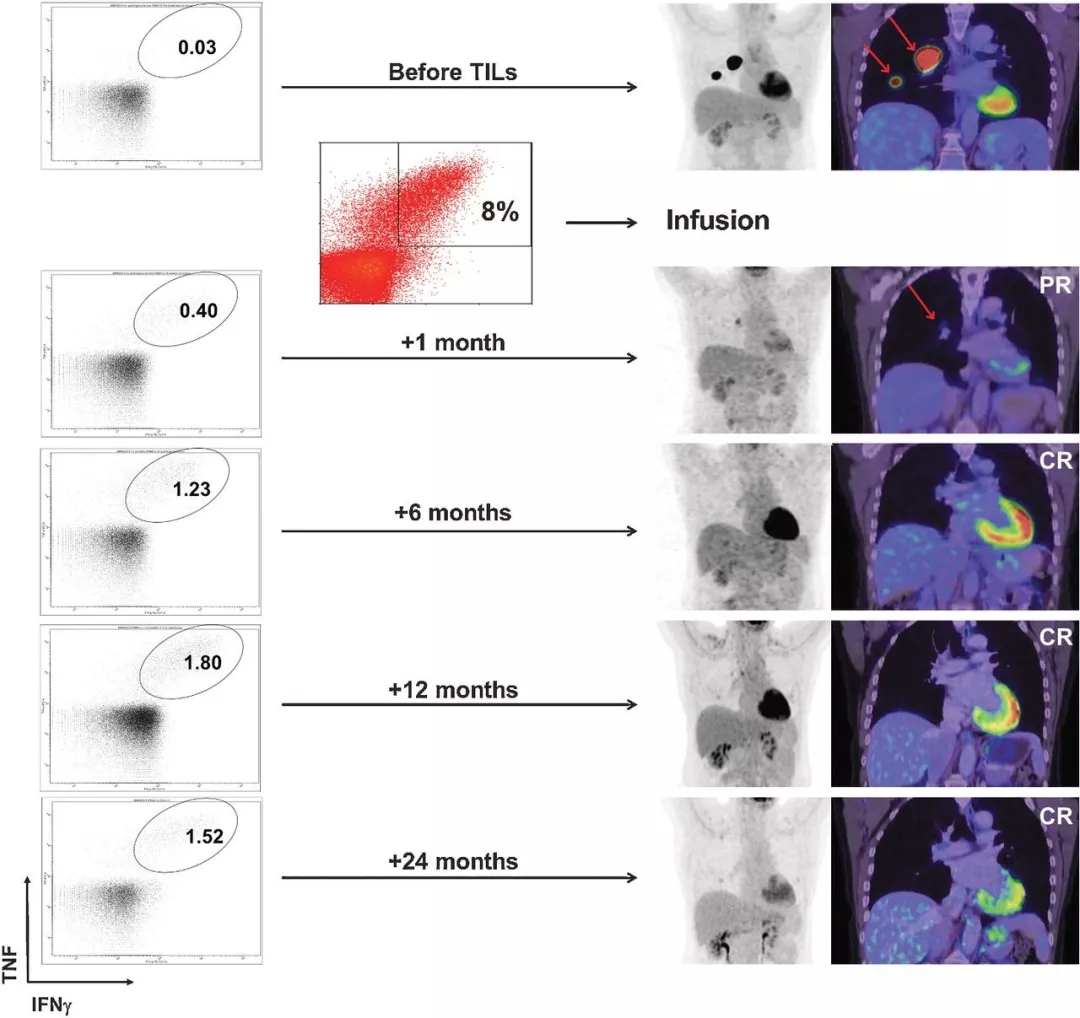

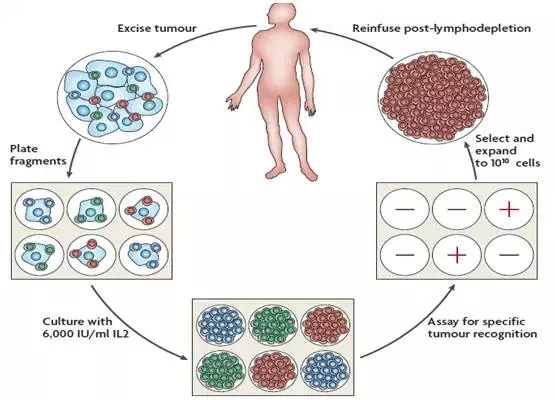
第一步,我們得到病人的腫瘤組織塊,其中混雜著體積較大的腫瘤細(xì)胞(淺藍(lán)色)以及體積小而圓的T淋巴細(xì)胞(紅色,綠色,深藍(lán)色);
第二步,將不同種類的T淋巴細(xì)胞在細(xì)胞板上克隆化,并加入高濃度的IL-2來選擇培養(yǎng);
第三步,在IL-2的刺激下不同種類的T淋巴細(xì)胞都得到了克隆擴(kuò)增,形成了細(xì)胞群;
第四步,用病人的腫瘤細(xì)胞和擴(kuò)增后的T淋巴細(xì)胞反應(yīng),凡是能夠發(fā)生殺瘤效應(yīng)的T淋巴細(xì)胞群作為陽性TIL群留下(紅色),其余的丟棄(綠色,深藍(lán)色);
第五步,用負(fù)載了腫瘤特異性抗原的樹突狀細(xì)胞(DC)進(jìn)一步擴(kuò)增培養(yǎng)腫瘤特異性的TIL,三周內(nèi)培養(yǎng)10億個TIL;最后,回輸給預(yù)先做了清髓的腫瘤病人。
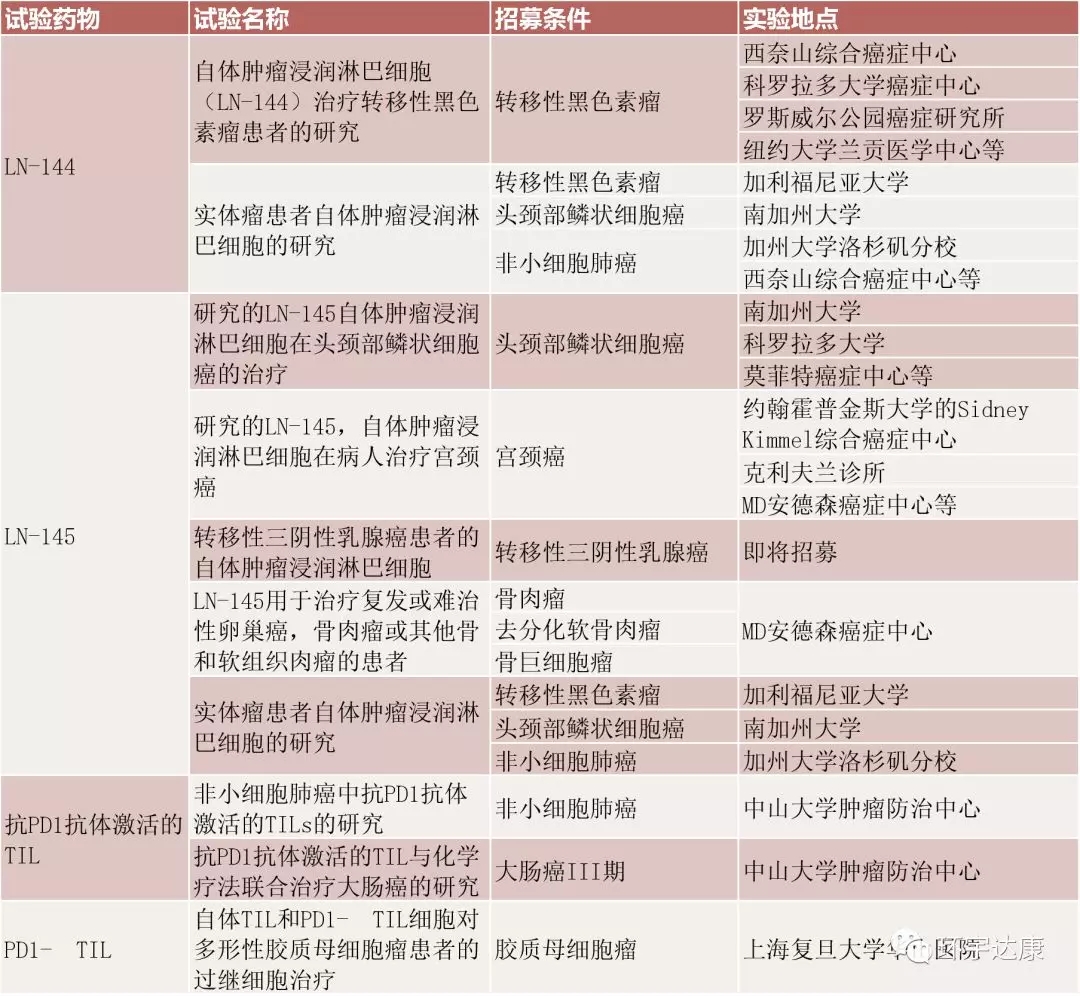
目前,這款新型的免疫療法暫未上市,但在全球范圍內(nèi)開展了多項針對各類實體腫瘤(非小細(xì)胞肺癌,結(jié)直腸癌,卵巢癌,黑色素瘤...)的臨床試驗,申請流程如下:
1.按要求將病歷資料提交至全球腫瘤醫(yī)生網(wǎng)醫(yī)學(xué)部;
2.醫(yī)學(xué)部初步評估后匹配合適的臨床試驗;
3.向相應(yīng)的試驗中心提交病歷資料;
4.評估通過后協(xié)助患者參加臨床試驗。
免疫腫瘤學(xué)的潛力剛剛開始實現(xiàn)。揭開更多的冰山將會更加詳細(xì)地了解如何控制免疫反應(yīng),以及將這些治療手段用于臨床獲得益處。每天我們能看到更多的進(jìn)展,我們相信這種治療方法將在未來幾年取得重大突破,讓我們共同期待。
參考資料: 1.https://www.iovance.com/wp-content/uploads/ASCO2019_Poster_C-145-04_cervical_FINAL.pdf