回顧2022,盡管資本寒冬席卷創(chuàng)新藥領(lǐng)域,但是新技術(shù)、新療法的發(fā)展并未停下腳步,細(xì)胞療法領(lǐng)域依然蓬勃發(fā)展。其中,CAR-T療法多樣化明顯出現(xiàn),新靶點和適應(yīng)癥陸續(xù)獲批,改善CAR-T療效的各種新技術(shù)也層出不窮。此外,行業(yè)對NK細(xì)胞這種通用現(xiàn)貨型藥物平臺也充滿期待,新成立的細(xì)胞藥物研發(fā)公司大多數(shù)選擇NK細(xì)胞作為平臺技術(shù),進(jìn)軍CAR-NK領(lǐng)域。展望2023,醫(yī)藥魔方綜合過去一年細(xì)胞療法領(lǐng)域交易合作/投融資、重大進(jìn)展、技術(shù)特色等,篩選了10家值得關(guān)注的細(xì)胞療法公司,以供參考。
核心技術(shù):下一代自體和同種異體CAR-T
2022動向:與羅氏達(dá)成超60億美元的合作+ 增發(fā)8050萬美元
魔方評分:?????
公司官網(wǎng):https://poseida.com/
Poseida Therapeutics是一家總部位于美國圣地亞哥的臨床階段生物制藥公司,致力于利用專有的基因工程平臺技術(shù)來創(chuàng)造具有治愈能力的下一代細(xì)胞和基因療法,并且由自體逐漸轉(zhuǎn)向同種異體CAR-T療法。
該公司的CAR-T細(xì)胞不含有單鏈可變片段(scFv)結(jié)構(gòu),而是由全人源的Centyrin結(jié)構(gòu)域組成。Centyrin是一種小型、簡單、高度穩(wěn)定的蛋白質(zhì),能以很高的特異性和親和力結(jié)合目標(biāo)抗原,在穩(wěn)定性高的同時具有低免疫原性。
不同于傳統(tǒng)的病毒載體系統(tǒng),Poseida專有的piggyBac DNA修飾系統(tǒng)使用非病毒載體將CAR分子基因遞送給T細(xì)胞,可以產(chǎn)生具有高百分比T記憶干細(xì)胞(TSCM細(xì)胞)的CAR-T產(chǎn)物。TSCM細(xì)胞具有自我更新能力和多能性,高TSCM細(xì)胞占比可以使候選藥物更有效、毒性更小、更耐用;非病毒載體制造成本低、生產(chǎn)時間短、誘變和腫瘤發(fā)生的風(fēng)險低;同時,PiggyBac的載貨量可達(dá)慢病毒載體的20倍,可以有效遞送超大片段基因,實現(xiàn)穩(wěn)定的轉(zhuǎn)基因表達(dá)。
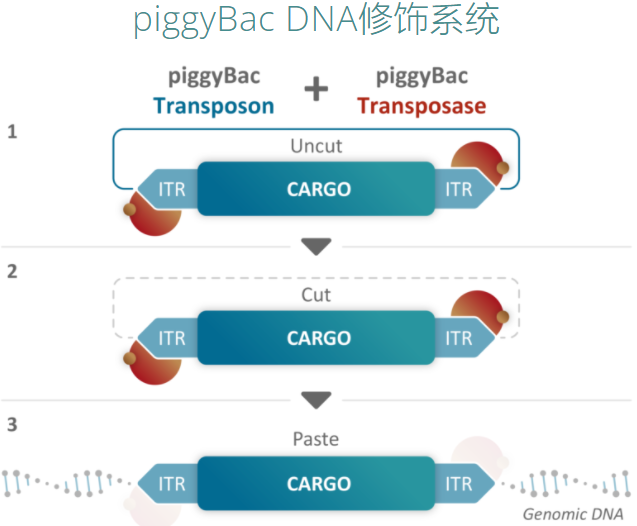 來源:Poseida官網(wǎng)
來源:Poseida官網(wǎng)
此外,Poseida使用Cas-CLOVER系統(tǒng)敲除CAR-T細(xì)胞中多種T細(xì)胞關(guān)鍵抑制信號的受體,可以保證CAR-T細(xì)胞的活化狀態(tài)。Cas-CLOVER使用了一種被稱為dCas9的Cas9酶,這種酶無法切割DNA,只有在與適當(dāng)?shù)囊龑?dǎo)RNA結(jié)合時才起到DNA 結(jié)合蛋白的作用。該系統(tǒng)能有效的避免TALEN技術(shù)只能用于激活的細(xì)胞的使用限制性和CRISPR/Cas9可能的脫靶突變帶來的潛在安全風(fēng)險。
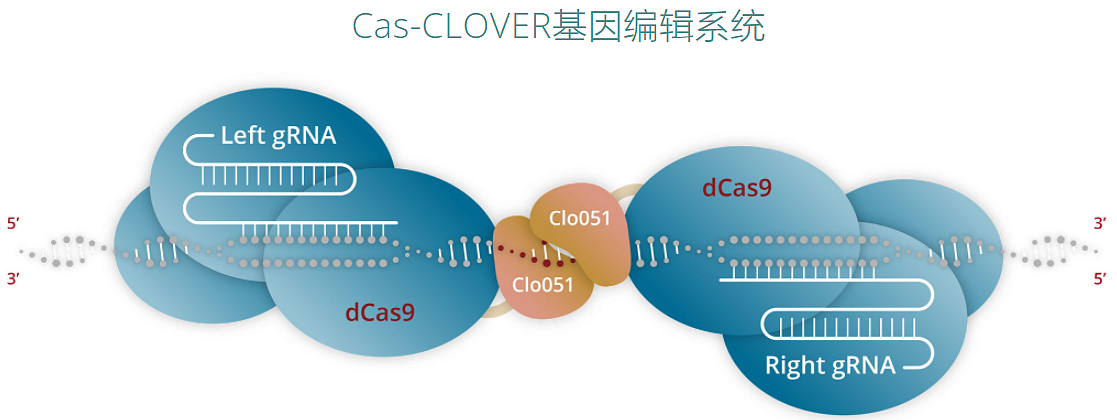 來源:Poseida官網(wǎng)
來源:Poseida官網(wǎng)
綜合來看,Poseida的在研產(chǎn)品旨在解決其他CAR-T療法的局限性,包括反應(yīng)持續(xù)時間、治療實體腫瘤的能力和安全性問題,其轉(zhuǎn)染、編輯以及遞送平臺都有獨特優(yōu)勢,可能帶來成本更低、生產(chǎn)時間更短的CAR-T療法,解決當(dāng)下的瓶頸。
該公司的技術(shù)平臺也得到了大藥企的認(rèn)可:2021年10月,與武田就新型非病毒體內(nèi)基因療法開展高達(dá)36億美元的研究合作;2022年8月,Poseida宣布與羅氏達(dá)成總額超60億美元的全球戰(zhàn)略合作與許可協(xié)議,這也是2022年細(xì)胞療法領(lǐng)域金額最高的“License in”交易。羅氏將從Poseida獲得獨家授權(quán),對Poseida產(chǎn)品組合中針對血液惡性腫瘤的一些同種異體CAR-T項目進(jìn)行開發(fā)和商業(yè)化。在與羅氏合作的消息發(fā)布之后,Poseida的股價暴漲了85%。
核心技術(shù):“可控”自體和同種異體CAR-T
2022動向:與吉利德旗下Kite達(dá)成潛在總額超40億美元合作 + IPO 1.423億美元 + 增發(fā)1.288億美元
魔方評分:?????
公司官網(wǎng):https://www.arcellx.com/
總部位于美國馬里蘭州的Arcellx致力于開發(fā)更安全、更有效、更廣泛的創(chuàng)新免疫療法,以治療癌癥和其它無法治愈的疾病。
2022年2月8日,公司宣布完成IPO,此次發(fā)行的總收益為1.423億美元。所獲資金將用于推動其主打CAR-T療法(CART-ddBCMA)進(jìn)入關(guān)鍵性臨床試驗,治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤(r/r MM),以及推動其“可控”CAR-T在研療法進(jìn)入臨床開發(fā)階段。CART-ddBCMA已獲FDA授予的快速通道資格、先進(jìn)再生醫(yī)學(xué)療法認(rèn)定,和孤兒藥資格。IPO前Arcellx累計融資超2億美元。
鑒于現(xiàn)有的細(xì)胞治療方案大多使用基于生物的scFv結(jié)合域,往往只對有限的部分患者有益,還常常導(dǎo)致高毒性,并且在可治療適應(yīng)癥中的適用性狹窄。Arcellx通過設(shè)計一類新的D-Domain驅(qū)動的自體和同種異體CAR-T細(xì)胞來克服這些限制,包括經(jīng)典的單次輸注CAR-T(稱為ddCARs)和可劑量控制的通用型CAR-T(稱為ARC-SparX)。
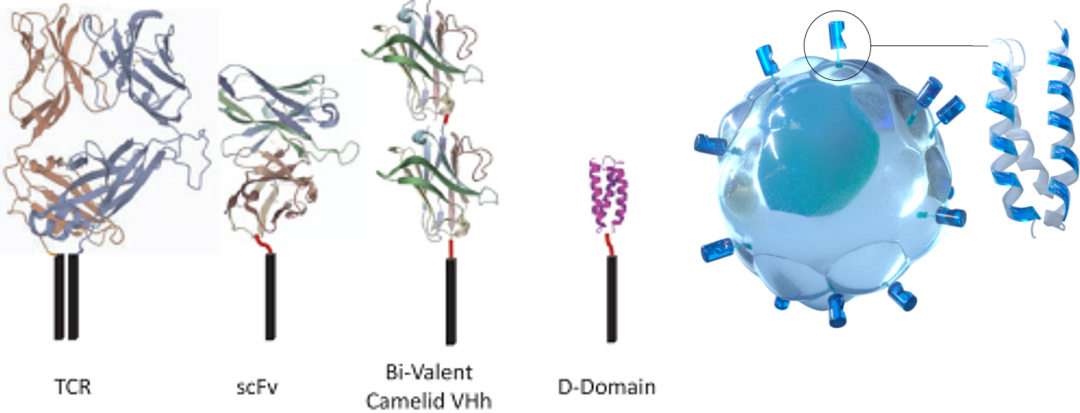 D-Domain是一種小型、穩(wěn)定、全合成的接合劑,具有疏水核。當(dāng)用于CAR時,其獨特的結(jié)構(gòu)可能實現(xiàn)更高的轉(zhuǎn)導(dǎo)效率、更高細(xì)胞表面表達(dá)和更低的強(qiáng)直信號傳導(dǎo),其設(shè)計目的是提高靶標(biāo)特異性,同時增強(qiáng)結(jié)合親和力。D-Domain的獨特性允許生成專有靶標(biāo)結(jié)合域的多樣庫,并作為Arcellx專有的ddCAR和ARC-SparX平臺的基礎(chǔ)。(來源:Arcellx招股書和官網(wǎng))
D-Domain是一種小型、穩(wěn)定、全合成的接合劑,具有疏水核。當(dāng)用于CAR時,其獨特的結(jié)構(gòu)可能實現(xiàn)更高的轉(zhuǎn)導(dǎo)效率、更高細(xì)胞表面表達(dá)和更低的強(qiáng)直信號傳導(dǎo),其設(shè)計目的是提高靶標(biāo)特異性,同時增強(qiáng)結(jié)合親和力。D-Domain的獨特性允許生成專有靶標(biāo)結(jié)合域的多樣庫,并作為Arcellx專有的ddCAR和ARC-SparX平臺的基礎(chǔ)。(來源:Arcellx招股書和官網(wǎng))
2022年12月9日,Arcellx公布了CART-ddBCMA在r/r MM中的I期臨床試驗數(shù)據(jù),患者ORR達(dá)到100%,38例可評估患者中27例(71%)達(dá)到CR或sCR,34例(89%)達(dá)到非常好的部分緩解(VGPR)以上的緩解。同一日,吉利德科學(xué)旗下Kite宣布與Arcellx達(dá)成潛在總額超40億美元的研發(fā)合作協(xié)議,將共同開發(fā)和商業(yè)化Arcellx的臨床后期在研療法CART-ddBCMA,用于治療r/r MM患者。
核心技術(shù):iPSC衍生的CAR-iNK和CAR-iT細(xì)胞療法
2022動向:與百時美施貴寶達(dá)成超30億美元合作+增發(fā)5000萬美元
魔方評分:?????
公司官網(wǎng):https://www.centurytherapeutics.com/
Century Therapeutics成立于2018年,總部位于美國費城,是一家面向新興的即用型同種異體細(xì)胞療法領(lǐng)域,專注于同種異體、誘導(dǎo)多能干細(xì)胞(iPSC)衍生的CAR-iNK和CAR-iT細(xì)胞療法的創(chuàng)新生物技術(shù)公司。
2019年7月1日,Century走出隱身模式,獲得了來自拜耳、Versant以及富士膠片株式會社子公司FCDI高達(dá)2.5億美元的融資,用于推進(jìn)其多項血液腫瘤和惡性實體瘤研究進(jìn)入臨床階段。2021年3月,Century宣布完成1.6億美元的C輪融資;6月,公司在納斯達(dá)克正式上市,擬募資2.11億美元。2022年1月,Century與百時美施貴寶(BMS)達(dá)成一項總額超30億美元的研究合作和許可協(xié)議,以聯(lián)合開發(fā)和商業(yè)化iPSC衍生的同種異體細(xì)胞療法,計劃用于治療血液系統(tǒng)惡性腫瘤和實體瘤。
Century在iPSC衍生療法領(lǐng)域的大步向前離不開其技術(shù)平臺的5個關(guān)鍵要素:
1)高效精準(zhǔn)的基因編輯技術(shù):提高基因組精確性與完整性;
2)專有的ALLO-EVASION?技術(shù):降低患者免疫排斥,有望重復(fù)給藥;
3)CAR與蛋白質(zhì)編輯:針對腫瘤異質(zhì)性和抗原缺失問題;
4)通用型工程化iPSC前體:其無限自我更新能力的iPSC技術(shù)能夠降低新產(chǎn)品開發(fā)的設(shè)計投入,加速候選產(chǎn)品研發(fā)的迭代;
5)簡化的制造過程。
目前,公司正在整合一系列同種異體iNK和iT細(xì)胞治療產(chǎn)品候選產(chǎn)品,涵蓋實體瘤和血液系統(tǒng)惡性腫瘤。所有候選產(chǎn)品均采用專有的Allo-Evasion?技術(shù),以避免宿主排斥反應(yīng),并可能提高臨床應(yīng)答的持久性。
 Century在研管線(來源:Century官網(wǎng))
Century在研管線(來源:Century官網(wǎng))
其中主要候選產(chǎn)品CNTY-101為iPSC來源的通用型CAR-iNK療法,被改造表達(dá)CD19 CAR、可溶性IL-15與EGFR安全開關(guān)。具體來說:1)使用Allo-Evasion?技術(shù)刪除β2M以消除HLA-1的表達(dá),防止自體T細(xì)胞殺傷;加入HLA-E表達(dá),以結(jié)合NKG2A,防止自體NK細(xì)胞殺傷;2)納入穩(wěn)態(tài)細(xì)胞因子IL-15,增加持久性和功能性;3)安全開關(guān)可允許通過注射西妥昔單抗的ADCC作用抹除表達(dá)EGFR的細(xì)胞,旨在必要時在體內(nèi)快速清除細(xì)胞。
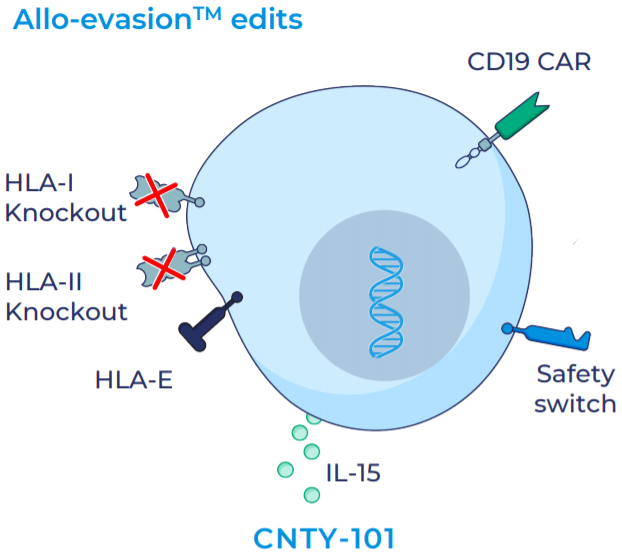 CNTY-101結(jié)構(gòu)示意圖(來源:Century)
CNTY-101結(jié)構(gòu)示意圖(來源:Century)
2022年8月25日, Century宣布美國FDA已批準(zhǔn)CNTY-101的IND申請,用于復(fù)發(fā)/難治性B細(xì)胞惡性腫瘤的治療。
核心技術(shù): CAR-γδ T細(xì)胞療法;TCR-γδ T細(xì)胞療法
2022動向:與BMS達(dá)成超14億美元合作 + 與 Editas Medicine達(dá)成未披露金額的合作
魔方評分:????
公司官網(wǎng):https://immatics.com/
Immatics成立于2000年,孵化自德國Tübingen大學(xué)的H.G. Rammensee實驗室,是一家活躍于發(fā)現(xiàn)和開發(fā)T細(xì)胞重定向癌癥免疫療法的生物技術(shù)公司,專注于免疫治療藥物的發(fā)現(xiàn)。
基于其獨特的靶點(XPRESIDENT?平臺)和T細(xì)胞受體(XCEPTOR?平臺)發(fā)現(xiàn)能力,Immatics開發(fā)了廣泛而多樣的癌癥免疫治療組合,建立了包括ACTengine?(自體)、ACTallo?(異體)、TCER?(雙特異性)方法為基礎(chǔ)的T細(xì)胞療法。
ACTengine?是一種個性化TCR-T療法,患者自身的T細(xì)胞經(jīng)過基因修飾,以表達(dá)新的專有TCR,然后將修飾的T細(xì)胞重新注入患者體內(nèi),以與腫瘤特異性結(jié)合。
ACTallo?是γδT細(xì)胞衍生的同種異體“現(xiàn)貨型”細(xì)胞療法。
TCER?是一種工程化“現(xiàn)貨型”生物制劑,旨在結(jié)合患者的循環(huán)T細(xì)胞,并將其帶到癌細(xì)胞附近并加以摧毀。其由一個直接識別癌細(xì)胞的TCR和一個招募及激活患者T細(xì)胞的T細(xì)胞招募域組成。
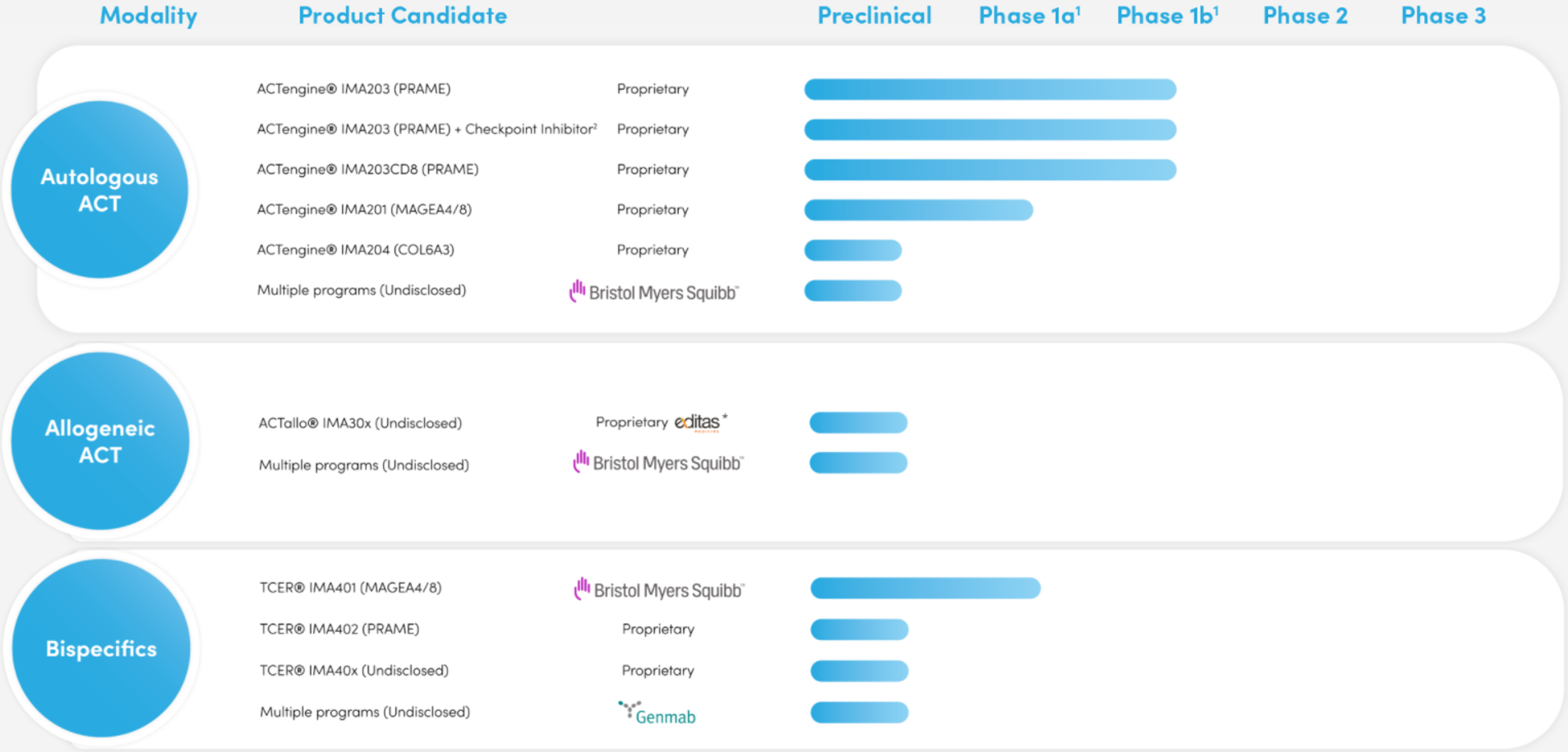 Immatic在研管線(來源:Immatic官網(wǎng))
Immatic在研管線(來源:Immatic官網(wǎng))
2022年10月10日,Immatics公布了其TCR-T療法ACTengine? IMA203的積極中期數(shù)據(jù),在Ib期臨床試驗部分,接受治療的5例患者中有4例(80%)獲得確認(rèn)客觀緩解。根據(jù)初步結(jié)果,公司同時宣布了一項新的公開募股,融資1.1億美元。
事實上,Immatics是TCR-T領(lǐng)域的吸金王,曾受到了各大制藥巨頭青睞。近年來其與Genmab(5.5億美元)、Amgen(13 億美元)、 Roche(10億美元)、Celgene(15.9億美元)、GSK(10億美元)、BMS(9.2億美元)等多家合作伙伴聯(lián)合開發(fā)過繼細(xì)胞療法和雙特異性抗體。
2022年6月2日,Immatics與BMS共同宣布,雙方擴(kuò)大戰(zhàn)略聯(lián)盟以開發(fā)多種同種異體現(xiàn)貨型TCR-T和/或CAR-T項目。本次合作總額超14億美元。同月7日,Immatics又與CRISPR基因編輯技術(shù)奠基人之一張鋒創(chuàng)立的Editas Medicine共同宣布,兩家公司已達(dá)成戰(zhàn)略研究合作和許可協(xié)議,將γδT 細(xì)胞過繼細(xì)胞療法和基因編輯相結(jié)合,以開發(fā)用于治療癌癥的藥物。
核心技術(shù):基于 CRISPR 基因編輯的 NK 細(xì)胞療法
2022動向:與賽諾菲達(dá)成10.25億美元
魔方評分:?????
公司官網(wǎng):https://www.scribetx.com/
Scribe總部位于美國加利福尼亞州,由CRISPR發(fā)明者以及領(lǐng)先的分子工程師Jennifer Doudna、Benjamin Oakes、Brett Staahl、David Savage共同創(chuàng)立,專注于為基于CRISPR的基因醫(yī)學(xué)設(shè)計最先進(jìn)平臺。公司已累計完成1.2億美元融資。
CRISPR是細(xì)菌和病毒進(jìn)行斗爭產(chǎn)生的免疫武器,可以在細(xì)菌中進(jìn)化為“基因破壞”形式,以抵御病原體。它在細(xì)菌中非常有效,但當(dāng)研究人員試圖將其用于人類時會遇到各種障礙。例如,對于體內(nèi)編輯,Cas9的大小使其不適合用于體內(nèi)基因編輯療法遞送的腺相關(guān)病毒(AAV)。
Scribe的X-editing (XE)技術(shù)是一項以創(chuàng)新CasX酶為基礎(chǔ)的系統(tǒng)。2019年,Jennifer Doudna團(tuán)隊在Nature上發(fā)表論文,證實了其于2016年發(fā)現(xiàn)的新型Cas蛋白——CasX可以用于基因組編輯,并揭示了新型基因組編輯工具CRISPR/CasX的潛在機(jī)制,該工具使用獨特的結(jié)構(gòu)進(jìn)行可編程的雙鏈DNA結(jié)合和切割。CasX最重要的應(yīng)用特點在于其比Cas9、Cas12a都要小得多,只有不到1000個氨基酸,可被包裹在AAV載體中。CasX不僅小巧,還具有獨特的可編程編輯方式,具備先前CRISPR-Cas基因組編輯技術(shù)缺乏的優(yōu)勢。
Scribe目前共有5個研發(fā)方向,包括:
神經(jīng)系統(tǒng)疾病(亨廷頓舞蹈癥、家族性漸凍癥、脊髓性肌萎縮癥、帕金森病、早發(fā)性家族性阿爾茨海默癥、天使綜合征等);
眼科疾病(色素性視網(wǎng)膜炎、視錐-視桿細(xì)胞營養(yǎng)不良、先天性黑蒙癥、青光眼、全色盲等);
多系統(tǒng)、肌肉和代謝疾病(囊性纖維化、杜氏肌營養(yǎng)不良、α1-抗胰蛋白酶缺乏癥、早衰癥、家族性高膽固醇血癥、苯丙酮尿癥等);
造血功能障礙疾病(鐮狀細(xì)胞病、重度聯(lián)合免疫缺陷、范可尼貧血、血友病A/B、慢性肉芽腫、血管性血友病);
細(xì)胞療法(CAR-T、NK、TiL、HSC、iPSC)。
 來源:Scribe Therapeutics官網(wǎng)
來源:Scribe Therapeutics官網(wǎng)
近年來,Scribe已先后與制藥巨頭渤健、賽諾菲達(dá)成戰(zhàn)略合作。2022年9月27日,賽諾菲宣布與 Scribe達(dá)成超10億美元的合作,開發(fā)基于 CRISPR 基因編輯的 NK 細(xì)胞療法來對抗癌癥。在此之前(2020年10月),Scribe 曾與渤健達(dá)成超4億美元合作,共同開發(fā)基于CRISPR的療法,以解決導(dǎo)致肌萎縮性側(cè)索硬化癥(ALS)的潛在遺傳病因。
核心技術(shù): 通用型CAR-NK細(xì)胞療法
2022動向:增發(fā)2.3億美元+公布了兩款CAR-NK在研產(chǎn)品的積極初步臨床數(shù)據(jù)
魔方評分:?????
公司官網(wǎng):https://www.nkartatx.com/
Nkarta Therapeutics成立于2015年,是一家專注于開發(fā)同種異體現(xiàn)貨型NK細(xì)胞療法用于癌癥治療的臨床階段生物制藥公司。2020年7月10日,Nkarta登陸納斯達(dá)克擬募集資金2.52億美元。上市前,該公司累計完成了1.25億美元融資。
Nkarta公司專有的NK細(xì)胞治療平臺旨在通過增強(qiáng)靶向性、大量的擴(kuò)增和延長這些免疫細(xì)胞的持久性,最大限度地提高NK細(xì)胞的治療效果,從而釋放出強(qiáng)大而持久的抗癌免疫介導(dǎo)攻擊。
為了提高NK細(xì)胞的抗腫瘤活性,一般會系統(tǒng)輸注臨床級的重組IL2或者單鏈IL15細(xì)胞因子,然而,這種方法往往伴隨嚴(yán)重的不良反應(yīng),且IL2輸注往往同時導(dǎo)致抑制性免疫細(xì)胞Treg的擴(kuò)增,抑制NK細(xì)胞的活性。因此,NK細(xì)胞臨床試驗多使用IL15。Nkarta公司通過基因工程的方法,使外周血NK細(xì)胞表達(dá)膜結(jié)合的IL15(mbIL15),提高了NK細(xì)胞的存活、增殖、殺傷能力。
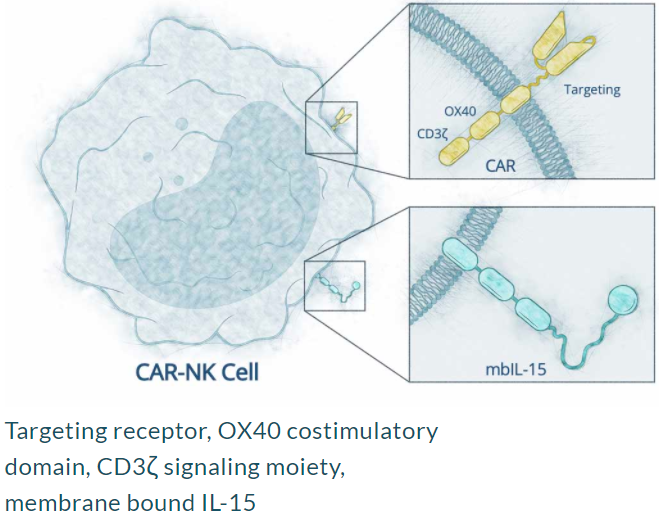 Nkarta公司設(shè)計的CAR-NK(來源:Nkarta官網(wǎng))
Nkarta公司設(shè)計的CAR-NK(來源:Nkarta官網(wǎng))
2022年4月,Nkarta公布了兩款CAR-NK在研產(chǎn)品:靶向NKG2D的NKX101和靶向CD19的NKX019治療血液瘤的積極初步臨床數(shù)據(jù)。NKX019治療復(fù)發(fā)/難治性非霍奇金淋巴瘤(r/r NHL) 患者,高劑量組6例中5例(83%)獲得了緩解(ORR),其中3例(50%)獲得了完全緩解(CR)。受此消息影響,該公司股價上漲140%。2022年12月,該公司又公布NKX019作為單藥治療 r/r NHL 患者的I期 積極研究結(jié)果,較高劑量水平治療組CR達(dá)70%,再振人心。
2022年4月28日,Nkarta宣布完成增發(fā)的2.3億美元融資,并擬將這筆收益用于資助 NKX101和 NKX019的臨床開發(fā)、研究階段項目的臨床前研究以及內(nèi)部制造能力的持續(xù)建設(shè)。
核心技術(shù):邏輯門控CAR-T
2022動向:B輪融資2.2億美元+與BMS、羅氏建立合作
魔方評分:????
公司官網(wǎng):https://www.arsenalbio.com/
Arsenal Biosciences成立于2019年,專注于整合基于CRISPR的基因編輯、規(guī)模化高通量靶點識別、合成生物學(xué)和機(jī)器學(xué)習(xí)等技術(shù),以推進(jìn)免疫細(xì)胞療法的發(fā)現(xiàn)和開發(fā)新范式。該公司正在構(gòu)建行業(yè)中最大型的治療增強(qiáng)整合回路文庫,利用邏輯門控改善腫瘤靶向,并且通過合成生物學(xué)讓CAR-T療法具有行使多種藥物功能的潛力。
2022年9月,Arsenal完成2.2億美元B輪融資,目前累計融資金額超3億美元。此外,2022年其與跨國制藥巨頭也達(dá)成了兩項合作:1月,Arsenal宣布擴(kuò)大與BMS的戰(zhàn)略合作,以發(fā)現(xiàn)和推進(jìn)用于治療實體瘤的T細(xì)胞療法;9月,Arsenal與羅氏旗下基因泰克達(dá)成7000萬美元合作協(xié)議, 運用Arsenal專有科技進(jìn)行高通量篩選與T細(xì)胞工程化,以識別T細(xì)胞類療法成功的關(guān)鍵樞紐,開發(fā)未來實體瘤療法。
公司聯(lián)合創(chuàng)始人之一,加州大學(xué)舊金山分校的Kole Roybal教授,憑借其開發(fā)的全新T細(xì)胞免疫療法成為2018年首屆Sartorius & Science Prize for Regenerative Medicine & Cell Therapy大獎得主。2021年其在Science Translational Medicine發(fā)表的幾篇論文指出,名為synNotch的調(diào)控系統(tǒng)能夠提高CAR-T細(xì)胞靶向特異性,提高細(xì)胞療法的持久性。
 Kole Roybal教授(來源:Arsenal官網(wǎng))
Kole Roybal教授(來源:Arsenal官網(wǎng))
值得一提的是,Arsenal也上榜了由生物醫(yī)藥行業(yè)知名媒體網(wǎng)站BioSpace評選的2021年度新一代(NextGen)生物新銳公司。入選公司皆在近幾年成立,BioSpace通過對公司資本助力、合作、研發(fā)管線、成長潛力以及創(chuàng)新方面進(jìn)行綜合評估。Arsenal的入選也體現(xiàn)其短短幾年內(nèi)對業(yè)界產(chǎn)生了重大影響。
核心技術(shù):基于合成生物學(xué)開關(guān)技術(shù)的TCR-T
2022動向:1.75億美元的A輪融資 + 與Metagenomi建立合作 + 入圍“Most Promising Biotech Startups of 2022”榜單
魔方評分:????
公司官網(wǎng):https://www.affinittx.com/
Affini-T Therapeutics是一家專注于T細(xì)胞免疫療法的初創(chuàng)公司,成立于2021年,總部位于波士頓。公司致力于通過調(diào)節(jié)免疫系統(tǒng)來靶向致癌驅(qū)動突變,為難治性實體瘤患者開發(fā)可能改善生活的藥物。公司創(chuàng)始團(tuán)隊及科學(xué)顧問委員會陣容豪華,包括Fred Hutchinson癌癥研究中心免疫學(xué)負(fù)責(zé)人、癌癥免疫治療專家Phil Greenberg博士,癌癥免疫療法先驅(qū)、諾貝爾生理學(xué)或醫(yī)學(xué)獎得主Jim Allison教授,知名癌癥免疫療法轉(zhuǎn)化科學(xué)家Pam Sharma教授等。
Affini-T的基礎(chǔ)細(xì)胞療法平臺建立在創(chuàng)始團(tuán)隊開創(chuàng)性工作的基礎(chǔ)上,旨在利用T細(xì)胞受體(TCR)發(fā)現(xiàn)引擎和一套合成生物學(xué)組件,開發(fā)靶向KRAS和p53等致癌驅(qū)動突變的潛在best-in-class療法。
具體來說,該公司團(tuán)隊利用先進(jìn)的合成生物學(xué)和基因編輯技術(shù),開創(chuàng)性地設(shè)計TCR-T細(xì)胞療法以靶向致癌驅(qū)動突變。公司的TCR發(fā)現(xiàn)平臺是一個強(qiáng)大的引擎,可用于識別罕見的高親和力TCR,在實體瘤中釋放免疫應(yīng)答。此外,Affini-T利用專有的合成生物學(xué)開關(guān)受體來重編程免疫細(xì)胞,可顯著改善T細(xì)胞在敵對腫瘤微環(huán)境中的增殖存活以及持久反應(yīng)的能力。
 Affini-T的技術(shù)通過協(xié)調(diào)CD4/CD8的協(xié)同反應(yīng),引發(fā)更深入和顯著的抗腫瘤效應(yīng)。(來源:Affini-T官網(wǎng))
Affini-T的技術(shù)通過協(xié)調(diào)CD4/CD8的協(xié)同反應(yīng),引發(fā)更深入和顯著的抗腫瘤效應(yīng)。(來源:Affini-T官網(wǎng))
核心技術(shù): 基于基因回路技術(shù)的同種異體CAR-NK
2022動向:與 DYNS 合并業(yè)務(wù)并上市,預(yù)計總收益約為 1.565 億美元
魔方評分:?????
公司官網(wǎng):https://www.sentibio.com/
Senti Biosciences是一家利用利用合成生物學(xué)設(shè)計“基因回路”以改善細(xì)胞和基因治療產(chǎn)品 的初創(chuàng)公司,出道即自帶 “光環(huán)”,由合成生物學(xué)奠基人James J. Collins及其學(xué)生盧冠達(dá)等于2016年聯(lián)合創(chuàng)辦。公司使命是用更智能的藥物來戰(zhàn)勝復(fù)雜的疾病,從而改變?nèi)藗兊纳睢T谛己喜⑸鲜星埃琒enti Bio累計完成了約2億美元的融資。
Senti Bio的基因回路是一種新穎的、專有的DNA組合,使細(xì)胞能夠感知環(huán)境、執(zhí)行邏輯并指導(dǎo)細(xì)胞產(chǎn)生治療性蛋白質(zhì),從而提高安全性和療效。該公司相信,其在活細(xì)胞中編程基因回路的方法可以使藥物開發(fā)者在幾乎任何細(xì)胞或基因藥物中構(gòu)建最佳功能。公司專有平臺包括特定的基因回路技術(shù),如邏輯門、小分子調(diào)節(jié)器、組合有效載荷和合成啟動子,這些技術(shù)有可能賦予細(xì)胞和基因治療產(chǎn)品更高的療效、精確度和控制能力。
Senti Bio的腫瘤學(xué)管線主要專注于3個臨床前階段項目:SENTI-202,一種邏輯門控(OR+NOT)現(xiàn)貨型CAR-NK細(xì)胞療法,旨在靶向和消除急性髓系白血病(AML)細(xì)胞,同時避免損傷健康骨髓;SENTI-301,一種可調(diào)節(jié)的多臂現(xiàn)貨型CAR-NK細(xì)胞療法,用于治療肝細(xì)胞癌(HCC);SENTI-401,一種邏輯門控(NOT)現(xiàn)貨型CAR-NK細(xì)胞療法,旨在靶向和消除結(jié)直腸癌(CRC)細(xì)胞,同時避免損傷其他部位的健康細(xì)胞。此外,該公司還與羅氏子公司Spark Therapeutics 和拜耳子公司 BlueRock Therapeutics合作,將其基因回路技術(shù)應(yīng)用于腫瘤學(xué)以外的領(lǐng)域。
2021年 12 月底,Senti Bio宣布與 DYNS 的SPAC 合并協(xié)議,預(yù)計合并總收益預(yù)計將超 2.96 億美元。當(dāng)時公告指出,雙方的合并交易已獲得 DYNS 和 Senti Bio 董事會的批準(zhǔn),預(yù)計合并的時間為 2022 年第二季度。2022年6月,Senti Bio與SPAC 合并上市交易如期完成,預(yù)計總收益約為 1.565 億美元 。
核心技術(shù):靶向?qū)嶓w瘤CAR-T
2022動向:B輪融資超1.2億美元
魔方評分:?????
公司官網(wǎng):https://www.oricell.com/
原啟生物成立于2015年,在2019年底獲得啟明創(chuàng)投近億元的Pre-A輪獨家投資后,作為生物創(chuàng)新藥研發(fā)資產(chǎn)從原能細(xì)胞集團(tuán)剝離,開始以創(chuàng)新型細(xì)胞治療技術(shù)平臺為核心,聚焦于腫瘤免疫治療領(lǐng)域的產(chǎn)品開發(fā)。
2022年3月, 原啟生物宣布任命原復(fù)星凱特CTO崔衛(wèi)東博士為首席技術(shù)官,負(fù)責(zé)公司工藝開發(fā)及生產(chǎn),加速推動公司靶向?qū)嶓w瘤的CAR-T產(chǎn)品臨床注冊及未來商業(yè)化進(jìn)展。8月,原啟生物宣布完成總金額超過1.2億美元的B輪融資,資金將主要用于推進(jìn)公司十余條經(jīng)過充分概念驗證(POC)的腫瘤細(xì)胞治療產(chǎn)品管線的開發(fā)和商業(yè)化進(jìn)程,繼續(xù)完善公司自主創(chuàng)新技術(shù)平臺的建設(shè),以及未來商業(yè)化生產(chǎn)基地的規(guī)劃與建設(shè)。
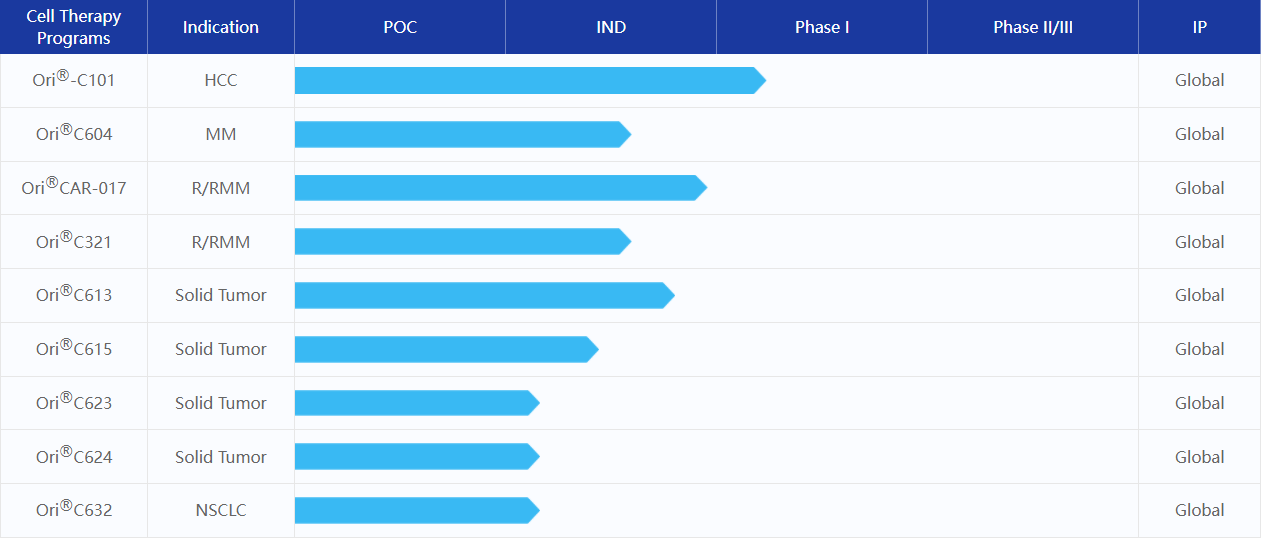 原啟生物CAR-T產(chǎn)品管線(來源:原啟生物官網(wǎng))
原啟生物CAR-T產(chǎn)品管線(來源:原啟生物官網(wǎng))
在產(chǎn)品研發(fā)進(jìn)展方面,公司首個自主開發(fā)靶向GPC3治療晚期肝癌的CAR-T產(chǎn)品(Ori-C101)的臨床試驗申請(IND)獲得了國家食品藥品監(jiān)督管理局藥品審評中心(CDE)的受理。在過往的臨床研究中,Ori-C101已經(jīng)在GPC3陽性晚期肝癌患者中表現(xiàn)出良好安全性和有效性。
原啟生物開發(fā)的中國首款GPRC5D CAR-T產(chǎn)品OriCAR-017 用于治療r/r MM,其研究者發(fā)起的I期臨床試驗(POLARIS)充分證實了該產(chǎn)品極大的開發(fā)前景。原啟生物以口頭報告形式分別在2022 ASCO、2022 EHA年會上公布了截止至2022年4月30日的臨床結(jié)果。數(shù)據(jù)顯示,包括5例既往BCMA CAR-T治療失敗的受試者在內(nèi)的所有受試者,均獲得100%客觀緩解率(ORR)和100%微小殘留病灶(MRD)陰性率,持續(xù)無進(jìn)展,無需任何額外抗腫瘤治療以及良好的安全性。目前,原啟生物正加快推進(jìn)其中美兩地的注冊及臨床開發(fā)速度。
核心技術(shù):下一代自體和同種異體CAR-T
2022動向:與羅氏達(dá)成超60億美元的合作+ 增發(fā)8050萬美元
魔方評分:?????
公司官網(wǎng):https://poseida.com/

2023年第41屆摩根大通醫(yī)療保健會議(JPM)正式恢復(fù)線下召開。
在第一天的報告出現(xiàn)了不少細(xì)胞與基因治療的公司,有不少公司都帶來了自己對2023年的積極展望,例如手握潛在首款DMD基因療法的Serepta公司、首款治療血友病A的獲批基因療法的BioMarin等;也有目前在監(jiān)管問題中掙扎的一些公司:例如遭FDA臨床暫停的Beam、裁員換血的Editas等。
bioSeedin將聚焦于Day 1 中的細(xì)胞與基因療法部分,對其公開的報告進(jìn)行整理與綜合。
在周一上午的演講中,諾華首席執(zhí)行官Vas Narasimhan表示:公司的 2023 年戰(zhàn)略側(cè)重于五個治療領(lǐng)域:心血管、免疫學(xué)、神經(jīng)科學(xué)、實體瘤和血液學(xué)。
Narasimhan說,該公司計劃在這些領(lǐng)域取得進(jìn)展的方式之一是通過其基因治療產(chǎn)品組合,并且表示諾華“內(nèi)部有超過15個項目正在繼續(xù)推進(jìn)”。
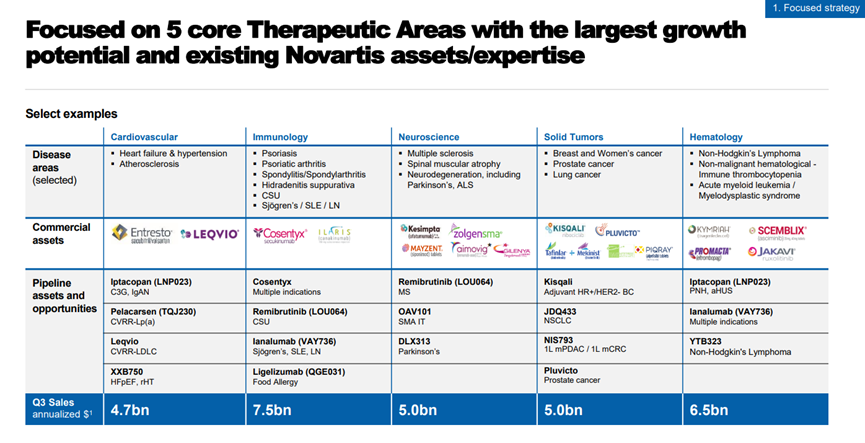
在免疫學(xué)方面,Narasimhan表示,諾華將使用其T-Charge平臺將把大部分精力集中在細(xì)胞和基因治療上。
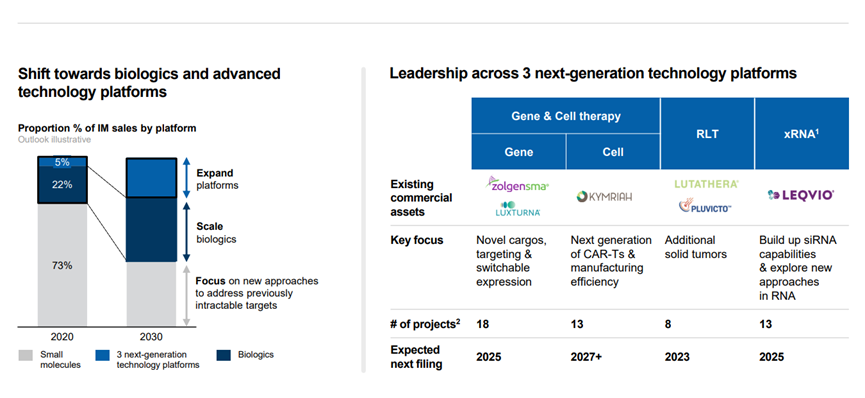
此外,諾華還特別指出了近期即將要公布臨床試驗讀數(shù)的關(guān)鍵資產(chǎn)。

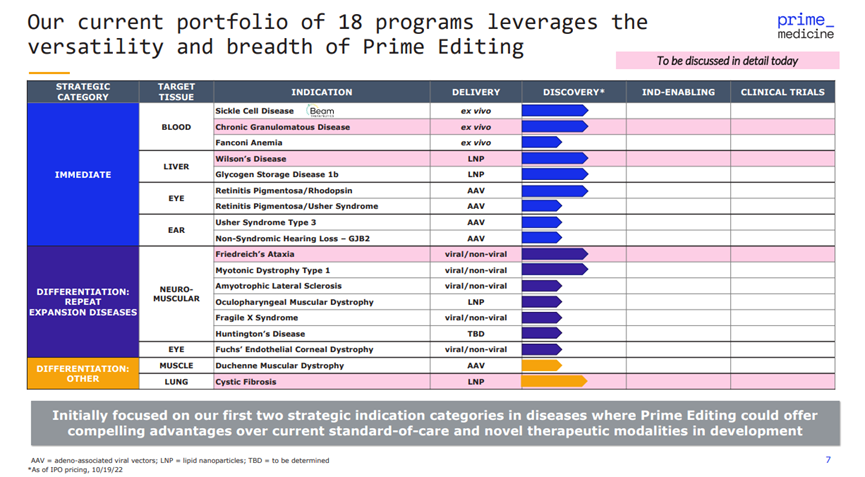
中午 12:12,Prime Medicine首席執(zhí)行官Keith Gottesdiener在JPM23會議上發(fā)表演講。Prime Medicine是劉如謙參與創(chuàng)立的第3家上市公司,專注于使用Prime Editing 技術(shù)進(jìn)行基因編輯。

Keith提到近期基因療法在FDA的屢屢碰壁,表示這些都是“成長的痛苦”,可能會在未來幾年內(nèi)得到解決。與此同時,他表示Prime公司擁有“強(qiáng)大的現(xiàn)金跑道”,暫時不擔(dān)心資金問題。
Prime 有 18 個項目正在開發(fā)中,不過都處于非常早期的階段。
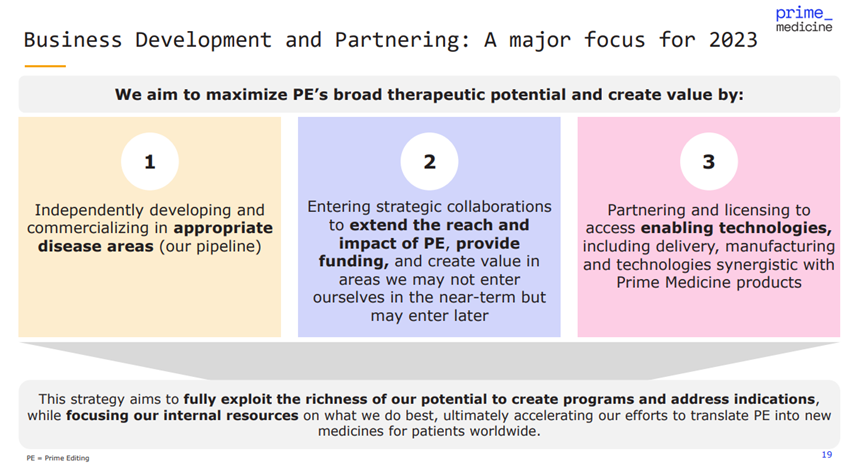
Keith表示,2023年,公司將著重尋找BD交易與外部合作的機(jī)會。
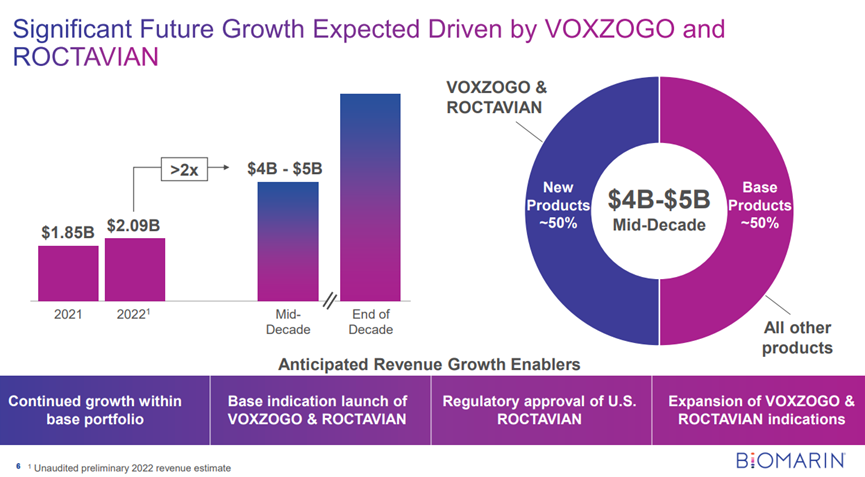
下午 12:51,BioMarin董事長兼首席執(zhí)行官J.J. Bienaimé發(fā)表演講,稱其基因治療產(chǎn)品Roctavian為迄今為止“最強(qiáng)勁的產(chǎn)品”。

Roctavian是一款治療嚴(yán)重血友病A的基因療法,使用AAV5病毒載體遞送表達(dá)凝血因子VIII的轉(zhuǎn)基因。今年8月24日,歐盟委員會(EC)批準(zhǔn)此基因療法有條件上市,成為首款用于治療血友病A的基因療法。
近日,BioMarin公司宣布了Roctavian取得3期臨床的積極結(jié)果,該試驗的隨訪時間超過了3年。這是目前規(guī)模最大,持續(xù)時間最長的血友病基因療法全球3期臨床試驗。

試驗結(jié)果顯示,在治療3年和4年的患者中,其凝血因子VIII的活性平均值分別為18.8和15.2,中位數(shù)值為8.4和7.4。兩組的平均年出血事件率分別為1.0和0.8,而中位值都為0.0。此外,兩組的年凝血因子平均使用次數(shù)分別為8.4和11.1,中位值也均為0。與基線值相比,在治療的第三年后,患者的平均年出血事件率減少了80%,而凝血因子VIII的使用減少了94%。
Bienaimé表示,他預(yù)計超過75%的美國處方者將在上市后一年內(nèi)采用Roctavian來治療嚴(yán)重的成人血友病A患者。加上Voxzogo,一種用于增加軟骨發(fā)育不全兒童(5歲及以上)線性生長的療法,Bienaimé預(yù)測到十年中期BioMarin的增長將達(dá)到40億至50億美元。
下午 1:30,Sarepta Therapeutics總裁兼首席執(zhí)行官Doug Ingram發(fā)表報告。

11月,F(xiàn)DA接受了Sarepta 公司的BLA申請,如果獲得批準(zhǔn),SRP-9001將成為市場上第一個針對杜氏肌營養(yǎng)不良(DMD)的基因療法。FDA已將PDUFA日期定為2023年5月29日。
SRP-9001是通過AAV將編碼微肌營養(yǎng)不良蛋白的基因傳遞到肌肉組織,使肌肉細(xì)胞表達(dá)對應(yīng)的蛋白,從而減緩或阻止肌肉退化。
該療法采用從非人靈長類動物中分離出的AAVrh74病毒載體,此病毒載體優(yōu)點是能夠在肌肉中引起轉(zhuǎn)基因的強(qiáng)力表達(dá),不會穿過血腦屏障進(jìn)入中樞神經(jīng)系統(tǒng),且較少患者體內(nèi)存在針對這一病毒載體的中和抗體。
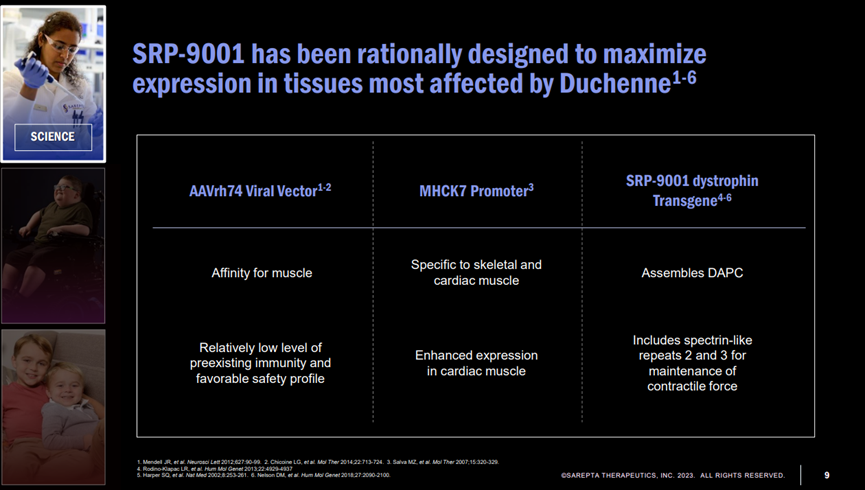
Doug Ingram在大會上公布了相關(guān)數(shù)據(jù),其中包括臨床前動物模型,功能數(shù)據(jù)和生物標(biāo)志物等,大量臨床前和臨床數(shù)據(jù)支持SRP-9001的療效。

下午4:47,Beam Therapeutics公司發(fā)表演講,該公司密切關(guān)注關(guān)注鐮狀細(xì)胞療法的市場。

Beam 公司報告了公司血液學(xué),免疫腫瘤學(xué)和遺傳疾病產(chǎn)品組合的進(jìn)展,并提供了預(yù)期即將到來的里程碑的最新情況。

第三季度財報中,Beam Therapeutics表示將停止對BEAM-102的IND申請進(jìn)程。BEAM-102用于治療鐮狀細(xì)胞病,通過直接編輯導(dǎo)致病變的血紅蛋白S點突變來重建正常的人類血紅蛋白。
今年7月,F(xiàn)DA暫停了其CAR-T 療法BEAM-201的IND申請,后又得到解除。BEAM-201針對CD7靶點,是首個同時針對4個基因展開編輯的CAR-T療法。
下基因編輯公司Editas Medicine在JPM宣布了重要戰(zhàn)略更新,包括投資組合重新確定優(yōu)先級和研發(fā)調(diào)整。該公司由張鋒、劉如謙共同創(chuàng)立,于2016年上市,是全球CRISPR基因編輯領(lǐng)域首家IPO的公司。

Editas表示,將停止對遺傳性視網(wǎng)膜疾病和臨床前全資擁有的iNK項目的內(nèi)部投資,專注于血紅蛋白病和體內(nèi)基因編輯。公司將資源優(yōu)先分配給EDIT-301,該項目用于治療嚴(yán)重鐮狀細(xì)胞病和輸血依賴性β地中海貧血。
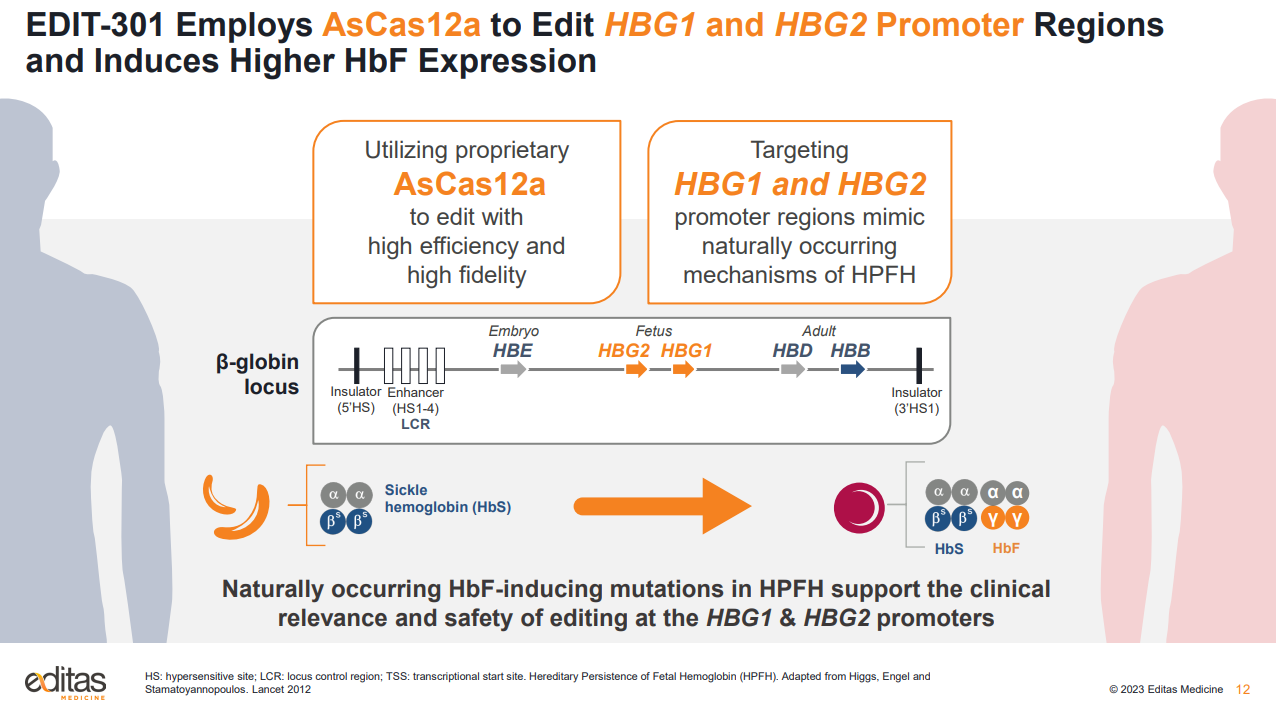
Editas希望為遺傳性眼病項目EDIT-101和EDIT-103尋找外部合作伙伴,但會繼續(xù)開發(fā)合作研發(fā)的細(xì)胞療法項目。
Editas裁員了20%,預(yù)計將把公司的現(xiàn)金跑道延長到2025年。此外,首席科學(xué)官Mark S. Shearman博士將從2023年3月31日起離開公司。